Структурная и молекулярная формула: ацетилен
Содержание:
- Виды изомерии
- Классификация органических соединений
- Реакции замещения
- Пространственная изомерия
- Номенклатура алкинов
- Химические свойства алкинов
- Гибридизация орбиталей атома углерода
- Некоторые специфические случаи:
- Изомерия алкинов. Зависимость свойств от строения
- Взрывоопасность ацетилена и безопасность при обращении с ним:
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:

2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):

2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:

2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):


Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия)
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла.
Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров

1,2-Диметилпропан также образует цис-транс-изомеры:

Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 оС, а транс-бутена-2 0,88оС.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.

Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:

Классификация органических соединений
Классификацию органических веществ определяют строение углеродной цепи (углеродного скелета) и наличие и особенности строения функциональных групп.
| Углеродный скелет – это последовательность соединенных между собой атомов углерода в органической молекуле. |
| Функциональная группа – это атом или группа атомов, которая определяет принадлежность молекулы к определенному классу органических веществ и химические свойства, соответствующие данному классу веществ. |
|
Классификация органических веществ по составу |
||
| Углеводороды | Кислородсодержащие вещества | Азотсодержащие вещества |
| Состоят из атомов углерода и водорода | Содержат также атомы кислорода | Содержат также атомы азота |
Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:

Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:

|
Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду.
На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |


Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300оС) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.

| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:

2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:

| Серная кислота способствует образованию электрофила NO2+: |

Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:

либо п-нитротолуол:

Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):

2.3. Алкилирование ароматических углеводородов
Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |

Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |

| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |

Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |

2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:

Пространственная изомерия
Для алкенов также характерна оптическая изомерия.
Алкины, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкина должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия для алкинов не характерна, так как по тройной связи вращение возможно.
Номенклатура алкинов
В названиях алкинов для обозначения тройной связи используется суффикс -ИН.
| Например, алкин на рисунке называется бутин-2 |
Для простейших алкинов применяются также исторически сложившиеся (тривиальные) названия:
| Название алкина | Формула алкина |
| Ацетилен | CH≡CH |
| Пропин | CH≡C−CH3 |
| Бутин-1 | CH≡C−СH2−CH3 |
Радикалы, содержащие тройную связь, также носят тривиальные названия:
| Формула радикала | Тривиальное название |
| CH≡C− | этинил |
| CH≡C−CH2− | пропаргил |
Химические свойства алкинов
Алкины – непредельные углеводороды, в молекулах которых есть одна тройная связь. Строение и свойства тройной связи определяют характерные химические свойства алкинов. Химические свойства алкинов схожи с химическими свойствами алкенов из-за наличия кратной связи в молекуле.
Для алкинов характерны реакции окисления. Окисление алкенов протекает преимущественно по тройной связи, хотя возможно и жесткое окисление (горение).
Гибридизация орбиталей атома углерода
Гибридизацией орбиталей называют процесс, при котором орбитали, изначально имеющие разные формы и энергии смешиваются, образуя взамен такое же количество гибридных орбиталей, равных по форме и энергии.
Так, например, при смешении одной s- и трех p-орбиталей образуются четыре sp3-гибридных орбитали:

В случае атомов углерода в гибридизации всегда принимает участие s-орбиталь, а количество p-орбиталей, которые могут принимать участие в гибридизации варьируется от одной до трех p-орбиталей.
Как определить тип гибридизации атома углерода в органической молекуле?
В зависимости от того, со скольким числом других атомов связан какой-либо атом углерода, он находится либо в состоянии sp3, либо в состоянии sp2, либо в состоянии sp-гибридизации:
| Количество атомов, с которыми связан атом углерода | Тип гибридизации атома углерода | Примеры веществ |
| 4 атома | sp3 | CH4 – метан |
| 3 атома | sp2 | H2C=CH2 – этилен |
| 2 атома | sp | HC≡CH — ацетилен |
Потренируемся определять тип гибридизации атомов углерода на примере следующей органической молекулы:
• Первый атом углерода связан с двумя другими атомами (1H и 1C), значит он находится в состоянии sp-гибридизации.
- Второй атом углерода связан с двумя атомами – sp-гибридизация
- Третий атом углерода связан с четырьмя другими атомами (два С и два Н) – sp3-гибридизация
- Четвертый атом углерода связан с тремя другими атомами (2О и 1С) – sp2-гибридизация.
Радикал. Функциональная группа
Под термином радикал, чаще всего подразумевают углеводородный радикал, являющийся остатком молекулы какого-либо углеводорода без одного атома водорода.
Название углеводородного радикала формируется, исходя из названия соответствующего ему углеводорода заменой суффикса –ан на суффикс –ил.
| Формула углеводорода | Название углеводорода | Формула радикала | Название радикала |
| CH4 | метан | -CH3 | метил |
| C2H6 | этан | -С2Н5 | этил |
| C3H8 | пропан | -С3Н7 | пропил |
| СnН2n+2 | …ан | -СnН2n+1 | … ил |
Функциональная группа — структурный фрагмент органической молекулы (некоторая группа атомов), который отвечает за её конкретные химические свойства.
В зависимости того, какая из функциональных групп в молекуле вещества является старшей, соединение относят к тому или иному классу.
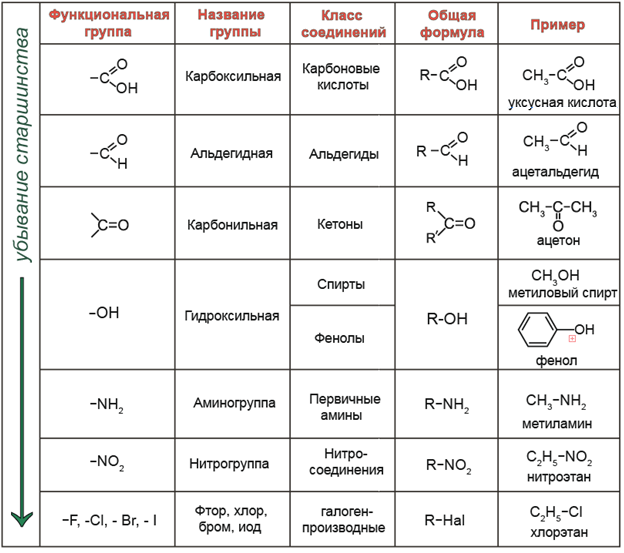
R – обозначение углеводородного заместителя (радикала).
Радикалы могут содержать кратные связи, которые тоже можно рассматривать как функциональные группы, поскольку кратные связи вносят вклад в химические свойства вещества.
Если в молекуле органического вещества содержится две или более функциональных группы, такие соединения называют полифункциональными.
Некоторые специфические случаи:
1. Координационные соединения
- В формуле любого комплексного соединения комплексную частицу следует выделять квадратными скобками: , H2, Na3, (NO3)2
- При наличии двух лигандов в комплексной частице порядок их перечисления не имеет значения: Ca2 или Ca2 (оба ответа будут засчитаны как верные)
- В случае амбидентантных лигандов следует корректно указывать связь атома комплексообразователя с лигандом. Например, не путать RNC (изонитрилы) и RCN (нитрилы).
2. Органические соединения
Органические соединения нужно называть в соответствии с правилами номенклатуры ИЮПАК, по заместительной или радикально-функциональной номенклатуре, допускаются тривиальные названия соединений, если это не запрещено в задании
При вводе структурной формулы соединения, необходимо обратить внимание, в каком виде вас просят ее написать, в сокращенном или развернутом. При этом, в обоих случаях необходимо правильно обозначить функциональные группы, входящие в состав молекул, некоторые из них приведены в таблице:
| Название функциональной группы |
Формула функциональной группы (запись ответа) |
|---|---|
| Карбоксильная группа | СOOH |
| Сложноэфирная группа (в данном примере — метоксикарбонильная) | СOOCH3 |
| Альдегидная группа | СHO |
| Кетонная группа | C(O) |
| Гидроксильная группа | OH |
| Аминогруппа | NH2 |
| Алкоксигруппа (простые эфиры, в данном случае этоксигруппа) | OCH2CH3 |
Определение
Структурная формула — форма записи, отображающая химическое строение (структуру) молекулы, составленная из символов химических элементов и специальных знаков (черточек), обозначающих взаимосвязь элементов в соответствии с их валентностью.
Структурная формула может быть записана в сокращенном и развернутом виде. Если в задании указано, что следует вводить сокращенную структурную формулу «сверните» все радикалы. Ниже приведены примеры записи сокращенной и развернутой структурных формул некоторых веществ:
| Название вещества | Развернутая структурная формула | Сокращенная структурная формула |
|---|---|---|
| пропаналь |
$H_3C-CH_2-CHO$ H3CCH2CHO |
$C_2H_5-CHO$ C2H5CHO |
| бутанон |
$H_3C-CH_2-C(=O)-CH_3$ H3CCH2C(O)CH3 |
$C_2H_5-C(O)-CH_3$ C2H5C(O)CH3 |
| этилацетат |
$CH_3C(O)−O−CH_2CH_3$ H3CCOOCH2CH3 |
$CH_3C(O)−O−C_2H_5$ H3CCOOC2H5 |
- Функциональные группы или заместители, расположенные внутри углеродного скелета, следует выделять скобками. Например, развернутую структурную формулу 2-хлорпентана можно изобразить несколькими способами: H3CCH2CH2CH(Cl)CH3 или H3C-CH2-CH2-CH(Cl)-CH3. В случае, если при одном атоме углерода расположено несколько заместителя, например в 3-метил-3-нитропентане, развернутую структурную формулу можно изобразить так: H3C-CH2-C(CH3)(NO2)-CH2-CH3.
- Порядок перечисления функциональных групп или заместителей при одном атоме С не имеет значения. Например, для 2-бром-2-метоксибутана развернутую структурную формулу можно записать несколькими способами: H3CC(Br)(OCH3)CH2CH3 или H3CC(OCH3)(Br)CH2CH3
Определение
Простейшая формула — это химическая формула, составленная из символов химических элементов и индексов, отражающая простейшее соотношение атомов этих элементов в молекуле.
Например, простейшая формула уксусной кислоты ($H_3C-COOH$) будет выглядеть как $C_2H_4O_2$. Ответ при этом записывается так: C2H4O2
Изомерия алкинов. Зависимость свойств от строения
Этин и пропин не имеют изомеров положения тройной связи, они появляются, начиная с бутина. Изомеры углеродного скелета есть у пентина и следующих за ним гомологов. Относительно тройной связи не проявляется пространственная изомерия ацетиленовых углеводородов.
Первые 4 гомолога этина — газы, плохо растворимые в воде. Ацетиленовые углеводороды C5 – C15 — жидкости. Твердыми веществами являются гомологи этина, начиная с углеводорода C17. Химическая природа алкинов испытывает значительное влияние тройной связи. Углеводороды этого типа активнее, чем этиленовые, присоединяют различные частицы. На этом свойстве основано широкое применение этина в промышленности и технике. При горении ацетилена выделяется большое количество теплоты, что находит применение в газовой резке и сварке металлов.
Взрывоопасность ацетилена и безопасность при обращении с ним:
Ацетилен обладает взрывоопасными свойствами.
Поэтому обращение с ацетиленом требует строгого соблюдения правил техники безопасности.
Ацетилен горит и взрывается даже в отсутствии кислорода и других окислителей.
Смеси ацетилена с воздухом взрывоопасны в очень широком диапазоне концентраций.
Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки.
Взрываемость ацетилена зависит от множества факторов: давления, температуры, чистоты ацетилена, содержания в нем влаги, наличия катализаторов и пр. веществ и ряда других причин.
Температура самовоспламенения ацетилена при нормальном – атмосферном давлении колеблется в пределах 500-600 °C. При повышении давления существенно уменьшается температура самовоспламенения ацетилена. Так, при давлении 2 кгс/см2 (0,2 МПа, 1,935682 атм.) температура самовоспламенения ацетилена равна 630 °C. А при давлении 22 кгс/см2 (2,2 МПа, 21,292502 атм.) температура самовоспламенения ацетилена равна 350 °С.
Присутствие в ацетилене частиц различных веществ увеличивают поверхность его контакта и тем самым снижает температуру самовоспламенения при атмосферном давлении. Например, активированный уголь снижает температуру самовоспламенения ацетилена до 400 °С, гидрат оксида железа (ржавчина) – до 280-300 °С, железная стружка – до 520 °С, латунная стружка – до 500-520 °С, карбид кальция – до 500 °С, оксид алюминия – до 490 °С, медная стружка – 460 °С, оксид железа – 280 °С, оксид меди – до 250 °С.
Взрывоопасность ацетилена уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
При определенных условиях ацетилен реагирует с медью, серебром и ртутью образуя взрывоопасные соединения. Поэтому при изготовлении ацетиленового оборудования (например, вентилей баллонов) запрещается применять сплавы, содержащие более 70 % Cu.
Для хранения и перевозки ацетилена используются специальные стальные баллоны белого цвета (с красной надписью «А»), заполненные инертным пористым материалом (например, древесным углём). При этом ацетилен хранится и перевозится в указанных баллонах в виде раствора ацетилена в ацетоне под давлением 1,5-2,5 МПа.
карта сайта
как получить ацетилен реакция ацетилен этен 1 2 вещество кислород водород связь является углекислый газ бромная вода уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение ацетилена напишите уравнение реакций ацетилен
comments powered by HyperComments









