Что такое co2 для аквариума?
Содержание:
- Что важней – свет, удобрения или СО2?
- Примечания
- Нормы углекислого газа в жилых помещениях
- Чем распылять СО?
- Основное применение
- Применения, основанные на инертности.
- Что нужно аквариумным растениям?
- Методы регистрации
- Физиологическое действие
- Свойства углекислого газа
- Методы регистрации
- Виды реакторов для аквариумов
- Получение диоксида углерода
- Взаимодействие с другими веществами:
- Применение
Что важней – свет, удобрения или СО2?
Формула, ведущая к успеху, проста: СО2 для аквариума, питательные вещества и свет. И относиться к ней нужно не фиктивно, а со всем уважением, потому, что все ее составляющие одинаково важны для жизни растений. Если «разогнать» систему в сторону одной из них, без учета двух остальных, то довольно быстро и неизбежно вы столкнетесь с проявлением закона Либиха вместо того, чтобы любоваться сильной и здоровой флорой в своем искусственном водоеме. Это так называемый эффект качелей. Причем, чем сильней разогнана система, тем большее вмешательство потребуется, а тем временем растения «устают и тоскуют».
В результате вместо бодрой зелени в аквариуме постепенно все тускнеет, а затем и вовсе часть посадок гибнет. Либо вода начнет заполняться водорослями, если наш «бульон» растения не смогут «переварить».
Примечания
- ↑
- .
- (англ.). National Oceanic and Atmospheric Administration. Дата обращения 24 сентября 2013.
- Chen Zhou, Mark D. Zelinka & Stephen A. Klein. (англ.). Nature Geoscience. Дата обращения 4 декабря 2019.
- Егоров А. С. Репетитор по химии — Ростов-на-Дону: «Феникс», 2009.
- (англ.). US EPA. Дата обращения 4 декабря 2019.
- Charles Henrickson. Chemistry (неопр.). — Cliffs Notes, 2005. — ISBN 0-7645-7419-1.
- ↑ Пересчитано из значений в мм. рт. ст. с использованием коэффициента пересчёта 0,133322 кПа/мм. рт. ст.
- ↑
- ↑ (недоступная ссылка). solarnavigator.net. Дата обращения 12 октября 2007.
- ↑
- Большая Энциклопедия Нефти и Газа.
- . Docs.cntd.ru. — М.: Стандартинформ, 2009.. Дата обращения 4 декабря 2019.
- Бялко А. В. Растения убыстряют рост // Природа. — 1996. — № 10. (по Keeling C.D., Whorf Т.P., Wahlen M., van der Plicht J. // Nature. 1995. V. 375, № 6533. P.666-670)
- (англ.)
- (англ.)
Нормы углекислого газа в жилых помещениях
Для жилых помещений действуют строительные нормативы концентрации СО2, в соответствии с ГОСТ 30494-2011, однако мнения физиологов на этот счет отличаются (они считают, что нормативы завышены и не могут обеспечить безопасность в действительности). Выделяют такие уровни «загазованности»:
- Атмосферный воздух, хорошее бодрое самочувствие: 400-600ppm по нормам и 300-400 по мнению физиологов;
- Нормальное качество: 800 (600);
- Среднее качество – 800-1000, однако на практике при верхнем пороговом значении каждый 2-й ощущает вялость, духоту, сонливость;
- Допустимая норма 1000-1400. Эти величины считаются предельно допустимыми значениями, но на практике у многих людей уже снижается внимательность, ухудшается восприятие и способность к обработке информации, нарушается дыхание, пересыхает слизистая в носоглотке;
- Воздух низкого качества – выше 1400 – провоцирует чувство сильной усталости, люди становятся безынициативными, не могут сосредоточиться на обычных делах, плохо засыпают. При превышении более 2000ppm 70% людей допускают ошибки в работе.
Нормы в школах
Чем больше углекислого газа в классе, тем сложнее воспринимать информацию и справляться с учебной нагрузкой. Так, в США действуют рекомендации, согласно которым концентрация СО2 в учебных помещениях не должна превышать 0,06%. В России по действующим стандартам объемная доля может составлять 0,08%. На практике такие величины соблюдаются редко – возможно 2-х или даже 3-х кратное превышение, из-за чего возникают потливость, заложенность носа, высокая утомляемость. Герметичные пластиковые окна существенно ухудшают естественную вентиляцию: в классе, где учится 25-30 человек, углекислый газ накаливается вдвое выше нормы всего за полчаса, то есть даже раньше, чем закончится урок. Поэтому рекомендуют проветривать помещение каждую перемену (если нет возможности провести комплексную модернизацию вентиляционной системы).
Нормы в офисах
Повышенное содержание углекислого газа в офисах провоцирует те же проблемы, что и в случае со школьниками в учебных учреждениях: производительность труда падает, а число ошибок растет. Согласно СанПин, допустимыми считаются уровни в диапазоне от 800 до 1400ppm, однако на практике уже при 1000 (0,1%) возникают признаки «передозировки».
В помещениях, где используется кондиционер, проблема только усугубляется. Ведь охлажденный воздух кажется комфортным, окна не открываются, вот только снижение температуры не приводит к понижению концентрации СО2
Поэтому важно установить специальный датчик, усовершенствовать систему вентиляции и следить за тем, чтобы плотность размещения сотрудников соответствовала действующим строительным стандартам – от 4 до 6,5 м2 на каждого человека
Чем распылять СО?
- Рябиновые ветки образуют маленькие пузыри, но быстро загрязняются. Используется сухая веточка рябины (диаметр – 6 мм), срезанная наискось с одной стороны и прямо — с другой. Прямым срезом веточка вставляется в трубку подачи газа. Диффузор готов.
- Камешковые распылители дают крупные пузырьки, поэтому газ растворяется хуже.
- Колокол изготавливается чаще всего из прозрачного колпачка от дезодоранта. Можно купить в магазине. Это устройство задерживает углекислоту.
- Стеклянные диффузоры прекрасно работают в баллонной системе подачи газа и с системой на основе лимонной кислоты и содового раствора. Без труда его можно приобрести в специализированном магазине.
Основное применение
CO2 широко применяется в промышленности и в быту – в огнетушителях и для изготовления газировки, для охлаждения продуктов и для создания инертной среды при сварке.

Основное применение углекислого газа
Применение углекислого газа отмечено в таких отраслях, как:
для чистки поверхностей сухим льдом.
Фармацевтика
- для химического синтеза компонентов лекарственных средств;
- создания инертной атмосферы;
- нормализация индекса pH отходов производства.

Углекислый газ в фармацевтике
Пищевая отрасль
- производство газированных напитков;
- упаковка продуктов питания в инертной атмосфере для продления срока годности;
- декаффеинизация кофейных зерен;
- замораживание или охлаждение продуктов.

Углекислый газ в пищевой отрасли
Медицина, анализы и экология
- Создание защитной атмосферы при полостных операциях.
- Включение в дыхательные смеси в качестве стимулятора дыхания.
- В хроматографических анализах.
- Поддержание уровня pH в жидких отходах производства.

Углекислый газ и экология
Электроника
- Охлаждение электронных компонентов и устройств при тестировании на температурную стойкость.
- Абразивная очистка в микроэлектронике (в твердой фазе).
- Очищающее средство в производстве кремниевых кристаллов.
Химическая отрасль
Широко применяется в химическом синтезе в качестве реагента и в качестве регулятора температур в реакторе. CO2 отлично подходит для обеззараживания жидких отходов с низким индексом pH.

Использование углекислого газа
Применяется также для осушения полимерных веществ, растительных или животных фиброматериалов, в целлюлозном производстве для нормализации уровня pH как компонентов основного процесса, так и его отходов.
Металлургическая отрасль
В металлургии CO2 в основном служит делу экологии, защиты природы от вредных выбросов путем их нейтрализации:

Применение углекислого газа в металлургии
- В черной металлургии — для нейтрализации плавильных газов и для донного перемешивания расплава.
- В цветной металлургии при производстве свинца, меди, никеля и цинка — для нейтрализации газов при транспортировке ковша с расплавом или горячих слитков.
- В качестве восстановительного агента при организации оборота кислотных шахтных вод.
Сварка в углекислой среде

Процесс сварки с применением углекислого газа
Разновидность сварки под флюсом является сварка в углекислой среде. Операции сварочных работ с углекислым газом осуществляется плавящимся электродом и распространен в процессе монтажных работ, устранении дефектов и исправления деталей с тонкими стенками.
Применения, основанные на инертности.
СО2 применяется как антиоксидант при долговременном хранении многих пищевых продуктов: сыра, мяса, сухого молока, орехов, растворимых чая, кофе, какао и т.д. Как вещество, подавляющее горение, СО2 используют при хранении и транспортировке горючих материалов, например ракетного топлива, масел, бензина, красок, лаков, растворителей. Он используется как защитная среда при электросварке углеродистых сталей с целью получения однородного прочного шва, при этом сварочные работы оказываются дешевле, чем при использовании инертных газов.
СО2 – одно из наиболее эффективных средств тушения пожаров, возникающих при воспламенении горючих жидкостей и электрических пробоях. Выпускают разные углекислотные огнетушители: от портативных емкостью не более 2 кг до стационарных установок автоматической подачи с общей емкостью баллонов до 45 кг или газовых резервуаров низкого давления емкостью до 60 т СО2. Жидкий СО2, находящийся в таких огнетушителях под давлением, при выпуске образует смесь из снега и холодного газа; последний обладает большей плотностью, чем воздух, и вытесняет его из зоны горения. Эффект усиливается еще и охлаждающим действием снега, который, испаряясь, переходит в газообразный СО2.
Что нужно аквариумным растениям?
Еще раз вспомним о том, что представляет собой СО2 и для чего он необходим растениям в аквариуме. СО2 для аквариума – это нужный растениям источник углерода, как пища для человека. Растения потребляют его на свету, однако в темноте им не меньше нужен кислород. Это первая проблема, с которой сталкиваются начинающие аквариумисты.
Если об этом забывать, то по ночам в аквариуме начнутся заморы. Даже если очевидной гибели флоры и не будет, то растения просто перестанут нормально расти, а это сделает бессмысленными все наши старания.
Другими словами, в аквариуме постоянно должна быть диффузия (аэрация). И кислорода должно хватать и на темную половину суток. Обычно его много в начале дня, но растения, как и дышащие им рыбы, его «выбирают» довольно быстро. В такой ситуации СО2 не только не сможет помочь, но и запросто усугубит проблему.

Не менее часто встречается другое. Новички в аквариумном деле, видя, как их, казалось бы, неприхотливая валлиснерия или несложная в уходе риччия с гигрофилой совершенно отказываются расти, начинают мудрить с CO2 и экспериментировать в надежде на улучшение. А дело вовсе не в недостаточном количестве углекислоты или света. Эти простые в содержании растения прекрасно живут и при меньшем освещении и в менее насыщенной углекислотой воде. Оказывается, что просто-напросто либо растения были куплены «на грани смерти», либо грунт слишком бедный или вода новая, еще не устоявшаяся.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO₂ в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф. Для измерения низких концентраций CO₂ (а также CO) в технологических газах или в атмосферном воздухе можно использовать газохроматографический метод с метанатором и регистрацией на пламенно-ионизационном детекторе.
Физиологическое действие
Углекислый газ в высоких концентрациях токсичен; при вдыхании его повышенных концентраций в воздухе по воздействию на воздуходышащие живые организмы его относят к удушающим газам (англ.)русск.. По ГОСТу (ГОСТ 8050-85) углекислота относится к IV классу опасности.
Незначительные повышения концентрации, вплоть до 0,2−0,4 % (2000−4000 ppm), в помещениях приводят к развитию у людей сонливости и слабости. Опасными для здоровья концентрациями считаются концентрации около 7−10 %, при которых развиваются симптомы удушья, проявляющиеся в виде головной боли, головокружения, расстройстве слуха и в потере сознания (симптомы, сходные с симптомами высотной болезни), эти симптомы развиваются, в зависимости от концентрации, в течение времени от нескольких минут до одного часа.
Для помещений нормальным является уровень CO₂ около 600 ppm (частей на миллион). Повышенные концентрации углекислого газа снижают когнитивные способности людей. Уже при 1200 ppm расширяются кровеносные сосуды в мозге, снижается активность нейронов и уменьшается объём коммуникации между регионами мозга. В школьных классах типичной является концентрация 2000−2500, а общий разброс значений — от 1000 до 6000, это вызывает обеспокоенность у исследователей, поскольку выявлено снижение результатов учеников, выполняющих тестовые задания в душных помещениях.
| Влияние на взрослых здоровых людей | Концентрация углекислого газа, ppm |
|---|---|
| Нормальный уровень на открытом воздухе | 350—450 |
| Приемлемые уровни | <600 |
| Жалобы на несвежий воздух | 600—1000 |
| Максимальный уровень стандартов ASHRAE и OSHA | 1000 |
| Общая вялость | 1000—2500 |
| Возможны нежелательные эффекты на здоровье | 1000—2500 |
| Максимально допустимая концентрация в течение 8 часового рабочего дня | 5000 |
При вдыхании воздуха с очень высокими концентрациями газа смерть наступает очень быстро от удушья, вызванного гипоксией.
Такой случай произошёл 28 февраля 2020 года когда в одном из банных комплексов Москвы в бассейн было высыпано 30 кг сухого льда который при возгонке вытеснил над водой воздух к потолку, в результате чего погибло 3 человека.
Несмотря на то, что даже концентрация 5—7 % CO₂ в воздухе несмертельна, но при концентрации 0,1 % (такое содержание углекислого газа иногда наблюдается в воздухе мегаполисов), люди начинают чувствовать слабость, сонливость. Это показывает, что даже при высоком уровне кислорода, большая концентрация CO₂ существенно влияет на самочувствие человека.
| Симптомы у взрослых здоровых людей | Концентрация углекислого газа, ppm |
|---|---|
| Лёгкое отравление, учащается пульс и частота дыхания, тошнота и рвота | 30 000 |
| Добавляется головная боль и лёгкое нарушение сознания | 50 000 |
| Потеря сознания, в дальнейшем — смерть | 100 000 |
Вдыхание воздуха с повышенной концентрацией этого газа не приводит к долговременным расстройствам здоровья. После удаления пострадавшего из атмосферы с высокой концентрацией углекислого газа быстро наступает полное восстановление здоровья и самочувствия.
Свойства углекислого газа
В 17 веке Жан-Батист Ван Гельмонт из Фландрии открыл углекислый газ и определил его формулу. Подробное исследование и описание было сделано столетие спустя шотландцем Джозефом Блэком. Он исследовал свойства углекислого газа и провел серию опытов, в которых доказал, что он выделяется при дыхании животных.
В нормальных условиях не обладает вкусом, цветом и запахом. Только вдыхая большое его количество, человек ощущает кислый привкус. Его дает угольная кислота, образующаяся в малых дозах при растворении углекислого газа в слюне. Эта особенность применяется для приготовления газированных напитков. Пузырьки в шампанском, просекко, пиве и лимонаде — это и есть углекислый газ, образовавшийся в результате естественных процессов брожения или добавленный в напиток искусственно.

Физические свойства углекислого газа
Плотность углекислого газа больше плотности воздуха, поэтому при отсутствии вентиляции он скапливается внизу. Он не поддерживает окислительные процессы, такие, как дыхание и горение.
Поэтому углекислоту применяют в огнетушителях. Это свойство углекислого газа иллюстрируют с помощью фокуса — горящую свечу опускают в «пустой» стакан, где она и гаснет. В действительности стакан заполнен CO2.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO₂ в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф. Для измерения низких концентраций CO₂ (а также CO) в технологических газах или в атмосферном воздухе можно использовать газохроматографический метод с метанатором и регистрацией на пламенно-ионизационном детекторе.
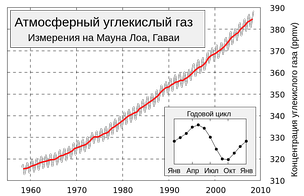 Изменения концентрации атмосферного углекислого газа (кривая Килинга). Измерения в обсерватории на горе Мауна-Лоа, Гавайи.
Изменения концентрации атмосферного углекислого газа (кривая Килинга). Измерения в обсерватории на горе Мауна-Лоа, Гавайи.
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) даёт малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).
Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемого топлива (угля, нефти, газа), заметно увеличивающееся в зимний сезон.
Большое количество углекислоты растворено в океане.
Виды реакторов для аквариумов
- «Колокол» — это выполненный по принципу перевернутого стакана любой реактор. Другими видами реакторов не рекомендуется растворять брагу, поскольку процесс выделения углекислоты станет неуправляемым, а плотность СО2 — неравномерной.
- Самый простой реактор подобного типа – это разовый шприц, прикрепленный к стенке аквариума на присоске. Довольно эстетично смотрятся и переделанные поилки для птиц, к тому же они недороги. Вариантов много: от пластикового стакана, перевернутого вверх дном, до сложных конструкций.
Эффективность любого реактора напрямую зависит от «контактного пятна» — размера площади соприкосновения воды с газом. Лаффарт советует на каждые 100 литров воды (жесткостью 10 гр.) делать площадь растворения 30 кв. см. Это не так много – всего-то 5х6 см.

Итак, существует дилемма – изготавливать большой реактор, либо маленький, в котором процесс растворения будет проходить намного лучше, чем в большом.
Такой эффект можно получить, если направить часть воды по тонкой трубке от фильтра под «флейту» для получения «фонтана» внутри реактора. Если организовать такую проточность, например, в реакторе из шприца (20 куб.), то растворение улучшится в несколько раз, а концентрация СО2 будет равномерной. А это равносильно применению реактора типа «колокол», который имеет более громоздкие размеры.
Получение диоксида углерода
Если требуется получить небольшое количество СО2,можно запустить реакцию соляной кислоты с карбонатом кальция (мрамором). Химическая запись этого взаимодействия выглядит так:
Также для этой цели используют реакции горения углеродсодержащих веществ, например ацетилена:
СН4 + 2О2 → 2H2O + CO2.
Для сбора и хранения полученного газообразного вещества используют аппарат Киппа.
Для нужд промышленности и сельского хозяйства масштабы получения диоксида углерода должны быть большими. Популярным методом такой масштабной реакции является обжиг известняка, в результате которого получается диоксид углерода. Формула реакции приведена ниже:
Взаимодействие с другими веществами:
1) Углекислота относится к кислотным оксидам, то есть в сочетании с водой образуется кислота. Однако угольная кислота неустойчива и распадается сразу. Эта реакция имеет обратимый характер:
Диоксид углерода + вода угольная кислота
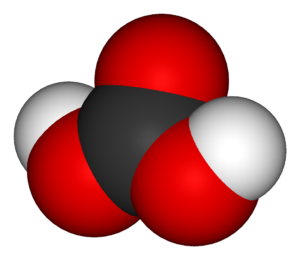 Молекула угольной кислоты
Молекула угольной кислоты
2) При взаимодействии углекислого газа и соединений азота с водородом (аммиаком) в водном растворе происходит разложение до углеаммонийной соли.
Аммиак + углекислота = гидрокарбонат аммония
 Углеаммонийная соль
Углеаммонийная соль
Полученное вещество часто используется в приготовлении хлеба и различных кондитерских изделий.
3) Ход некоторых реакций должен поддерживаться высокими температурами. Примером является производство мочевины при 130 °C и давлении 200 атм., схематически изображаемое так:
Аммиак + диоксид углерода → карбамид + вода
Также под воздействием температуры около 800 градусов протекает реакция образования оксида цинка:
 Оксид цинка
Оксид цинка
Цинк + двуокись углерода → оксид цинка + оксид углерода
4) Возможно уравнение с гидроксидом бария, при котором выделяется средняя соль.
Гидроксид бария + углекислота = карбонат бария + оксид водорода.
Применяется для регулировки калориметров по теплоемкости. Также вещество используют в промышленности для производства красных кирпичей, синтетических тканей, фейерверков, гончарных изделий, плитки для ванн и туалетов.
5) Углекислый газ выделяется при реакциях горения.
Горение метана.
 Горение газа на плите
Горение газа на плите
Метан + кислород = углекислота + вода (в газообразном состоянии) + энергия
Горение этилена
Этилен + кислород = диоксид углерода + оксид водорода + энергия
Горение этана
Этан + кислород = двуокись углерода + вода + энергия
Горение этанола
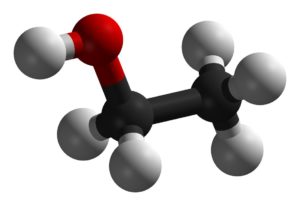 Молекула этанола
Молекула этанола
Этанол + кислород = вода + углекислота + энергия
6) Газ не поддерживает горения, этот процесс возможен только с некоторыми активными металлами, например, магнием.
Магний + углекислота = углерод + оксид магния.
MgO активно применяется при производстве косметических средств. Вещество используют в пищевой промышленности как пищевую добавку.
7) Двуокись углерода реагирует с гидроксидами с получением солей, которые существуют в двух формах, как карбонаты и бикарбонаты. Например, углекислый газ и гидроксид натрия, согласно формуле, образуют гидрокарбонат Na:
диоксид углерода + гидроксид натрия → гидрокарбонат натрия.
Или же при большем количестве NaOH образуется карбонат Na с образованием воды:
Диоксид углерода + гидроксид натрия → карбонат натрия + вода
Кислотно-щелочные реакции углекислоты используются на протяжении веков для затвердевания известкового раствора, что может быть выражено простым уравнением:
Гидроксид кальция + двуокись углерода → карбонат кальция + оксид водорода
8) В зелёных растениях играет важную роль в процессе фотосинтеза:
Образование глюкозы
Диоксид углерода + вода → глюкоза + кислород.
9) Химические свойства углекислоты используются в промышленности при производстве соды, суть этого процесса можно выразить суммарным уравнением:
Хлорид натрия + Диоксид углерода + аммиак + вода → гидрокарбонат натрия + хлорид аммония
10) Фенолят Na разлагается при взаимодействии с углекислым газом, при этом малорастворимый фенол выпадает в осадок:
Фенолят натрия + двуокись углерода + оксид водорода = фенол + гидрокарбонат натрия
11) Пероксид натрия и углекислый газ, взаимодействуя, образуют среднюю соль карбоната Na с выделением кислорода.
Пероксид натрия + углекислота → карбонат натрия + кислород
Колба с пероксидом натрия
Образование углекислоты происходит при растворении в воде кальцинированной соды (стиральной соды).
Гидрокарбонат натрия + вода → углекислота + вода + гидроксид натрия
При этой реакции (гидролиз по катиону) образуется сильнощелочная среда.
12) CO2 вступает в реакцию с гидроксидом калия, последний образуется путем электролиза хлористого калия.
Гидроксид калия + углекислота → карбонат калия + вода
13) Газ в силу своего строения не реагирует с благородными газами, то есть гелием, неоном, аргоном, криптоном, ксеноном, радоном, оганесоном.
Применение
Пищевая добавка Е290 применяется в производстве газированных напитков, в составе разрыхлителя для теста, выпечки и кондитерских изделий, при заморозке свежих продуктов, мороженного.
В криохирургии используется как одно из основных веществ для криоабляции новообразований.
Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях. Автоматические углекислотные установки для пожаротушения различаются по системам пуска, которые бывают пневматическими, механическими или электрическими.
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространенный метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги. При брожении, выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений.
Углекислый газ используется для газирования лимонада и газированной воды. Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его распад с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании.
Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31 °С. В стандартный 40-литровый баллон заливают около 30 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см2). Если температура будет выше +31 °С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см2), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа, — таким образом, работа с подобными баллонами может считаться вполне безопасной.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при посадке внатяг) и т. д. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки.
Польза и вред
Е290 считается нетоксичным (4 класс опасности ГОСТ 12.1.007), но при вдыхании диоксида углерода в повышенных концентраций в воздухе по воздействию на воздуходышащие живые организмы его относят к удушающим газам.
Незначительные повышения концентрации, вплоть до 2–4 %, в помещениях приводят к развитию у людей сонливости и слабости. Опасными для здоровья концентрациями считаются концентрации около 7–10 %, при которых развиваются симптомы удушья, проявляющиеся в виде головной боли, головокружения, расстройстве слуха и в потере сознания (симптомы, сходные с симптомами высотной болезни), эти симптомы развиваются, в зависимости от концентрации, в течение времени от нескольких минут до одного часа.
При вдыхании воздуха с очень высокими концентрациями газа смерть наступает очень быстро от удушья, вызванного гипоксией.
Несмотря на то, что даже концентрация 5–7 % CO₂ в воздухе несмертельна, но при концентрации 0,1 % (такое содержание углекислого газа иногда наблюдается в воздухе мегаполисов), люди начинают чувствовать слабость, сонливость. Это показывает, что даже при высоком уровне кислорода, большая концентрация CO2 существенно влияет на самочувствие человека.









