Реакции окисления органических веществ
Содержание:
Химические свойства алкинов.
Химические свойства алкинов объясняет наличие тройной связи в молекуле алкина. Типичная реакция для алкинов – реакция присоединения, которая протекает в 2 стадии. На первой происходит присоединение и образование двойной связи, а на второй – присоединение к двойной связи. Реакция у алкинов протекает медленнее, чем и алкенов, т.к. электронная плотность тройной связи «размазана» более компактно, чем у алкенов, и поэтому менее доступна для реагентов.
1. Галогенирование. Галогены присоединяются к алкинам в 2 стадии. Например,

А суммарно:

Алкины также как алкены обесцвечивают бромную воду, поэтому эта реакция является качественной и для алкинов.
2. Гидрогалогенирование. Галогенводороды присоединяются к тройной связи несколько тружднее, чем к двойной. Для ускорения (активации) процесса используют сильную кислоту Льюиса – AlCl3. Из ацетилена при таких условиях модно получить винилхлорид, который идет на производства полимера – поливинилхлорида, имеющего важнейшее значение в промышлености:
 .
.
Если же галогенводород в избытке, то реакция (особенно у несимметричных алкинов) идет по правилу Марковникова:

3. Гидратация (присоединение воды). Реакция протекает только в присутствии солей ртути (II) в качестве катализатора:

На 1ой стадии образуется непредельный спирт, в котором гидроксигруппа находится у атома углерода, образующего двойную связь. Такие спирты называются виниловыми или фенолами.
Отличительная черта таких спиртов – неустойчивость. Они изомеризуются в более стабильные карбонильные соединения (альдегиды и кетоны) вследствие переноса протона от ОН-группы к углероду при двойной связи. При этом π-связь рвется (между атомами углерода), и образуется новая π-связь между атомомами углерода и атомом кислорода. Такая изомеризация происходит из-за большей плотности двойной связи С=О по сравнению с С=С.
Только ацетилен превращается в альдегид, его гомологи — в кетоны. Реакция протекает по правила Марковникова:

Эта реакция носит названия – реакции Кучерова.
4. Те алкины, которые имеют концевую тройную связь, могут отщеплять протон под действием сильных кислотных реагентов. Такой процесс обусловлен сильной поляризацией связи .
Причиной поляризации служит сильная электроотрицательность атома углерода в sp-гибридизации, поэтому алкины могут образовывать соли – ацетилениды:

Ацетилениды меди и серебра легко образуются и выпадают в осадок (при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди). Эти реакции являются качественными на концевую тройную связь:

Полученные соли легко разлагаются под действием HCl, в результате выделяется исходный алкин:

Поэтому алкины легко выделить из смеси других углеводородоров.
5. Полимеризация. При участии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий, могут образовываться различные продукты. Например, под воздействием хлорида меди (I) и хлорида аммония:

Винилацетилен (полученное соединение) присоединяет хлороводород, образуя хлорпрен, который служит сырьем для получения синтетического каучука:

6. Если ацетилен пропускать через уголь при 600 ºС, получают ароматическое соединение – бензол. Из гомологов ацетилена, получают гомологи бензола:
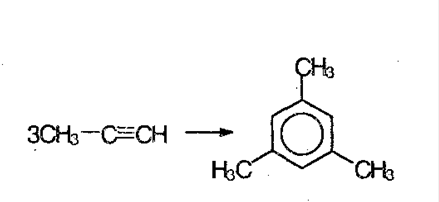
7. Реакция окисления и восстановления. Алкины легко окисляются перманганатом калия. Раствор обесцвечивается, т.к. в исходном соединении есть тройная связь. При окислении происходит расщепление тройной связи с образованием карбоновой кислоты:

В присутствие металлических катализаторов происходит восстановление водородом:

Безопасность
Как уже говорилось, ацетилен — огнеопасное вещество. С кислородом или воздухом он способен образовывать крайне легковоспламеняющиеся смеси. Чтобы вызвать взрыв, достаточно одной искры от статического электричества, нагрева до 500 °C или небольшого давления. При температуре 335 °C чистый ацетилен самовоспламеняется.
Из-за этого ацетилен хранят в баллонах под давлением, которые наполнены пористым веществом (пемза, активированный уголь, асбест). Таким образом, ацетилен распределяется по порам, уменьшая риск взрыва. Часто эти поры пропитывают ацетоном, из-за чего образуется раствор ацетилена. Иногда ацетилен разбавляют другими, более инертными газами (азот, метан, пропан).
Этот газ обладает и токсичным действием. При его вдыхании начнется интоксикация организма. Признаками отравления являются тошнота, рвота, шум в ушах, головокружение. Большие концентрации могут приводить даже к потере сознания.
Физические свойства алкинов
Алкины, за исключением ацетилена, не имеют цвета и запаха. При нормальных условиях первые 4 члена ряда являются газами, с 5 по 15 – жидкостями, более 15 – твердыми веществами.
Растворимость алкинов
Алкины являются относительно полярными молекулами, поэтому хорошо растворимы в полярных растворителях или растворителях с низкой полярностью. В воде алкины растворяются незначительно, но лучше, чем алканы и алкены.
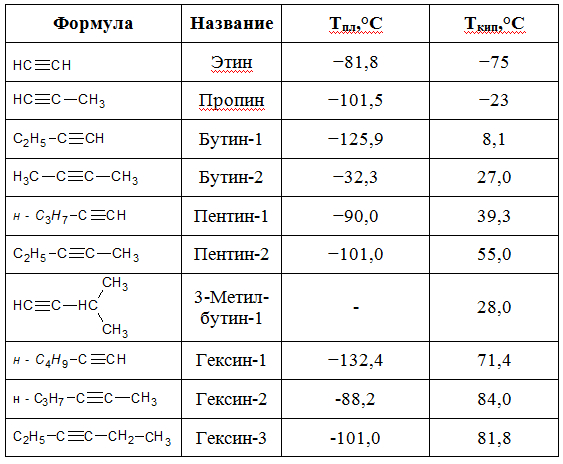
Точки плавления и кипения алкинов
Как правило, алкины плавятся и кипят при более высоких температурах, по сравнению соответствующих алканов и алкенов. Температуры плавления и кипения алкинов, увеличиваются пропорционально их молекулярной массе.
В таблице приведены физические постоянные некоторых алкинов:
Химические свойства ароматических углеводородов
Ароматический характер связи влияет на химические свойства бензолов и других ароматических углеводородов.
Единая 6пи–электронная система намного более устойчива, чем обычные пи-связи. Поэтому для ароматических углеводородов более характерны реакции замещения, а не присоединения. В реакции замещения арены вступают по электрофильному механизму.
Реакции замещения
Галогенирование
Нитрование
Лучше всего реакция нитрования протекает под действием не чистой азотной кислоты, а ее смеси с концентрированной серной кислотой, так называемой нитрующей смеси:
Алкилирование
Реакция при которой один из атомов водорода при ароматическом ядре замещается на углеводородный радикал:
Также вместо галогенпроизводных алканов можно использовать алкены. В качестве катализаторов можно использовать галогениды алюминия, трехвалентного железа или неорганические кислоты.<
Реакции присоединения
Присоединение хлора
Протекает по радикальному механизму при интенсивном облучении ультрафиолетовым светом:
Подобным образом реакция может протекать только с хлором.
Реакции окисления
Неполное окисление
Бензольное кольцо устойчиво к действию таких окислителей как KMnO4 и K2Cr2O7. Реакция не идет.
Галогенирование
Молекулу толуола можно рассматривать, как состоящую из фрагментов молекул бензола и метана. Поэтому логично предположить, что химические свойства толуола должны в какой-то мере сочетать химические свойства этих двух веществ, взятых по отдельности. В частyости, именно это и наблюдается при его галогенировании. Мы уже знаем, что бензол вступает в реакцию замещения с хлором по электрофильному механизму, и для осуществления данной реакции необходимо использовать катализаторы (галогениды алюминия или трехвалентного железа). В то же время метан так же способен реагировать с хлором, но уже по свободно-радикальному механизму, для чего требуется облучение исходной реакционной смеси УФ-светом. Толуол, в зависимости от того, в каких условиях подвергается хлорированию, способен дать либо продукты замещения атомов водорода в бензольном кольце – для это нужно использовать те же условия что и при хлорировании бензола, либо продукты замещения атомов водорода в метильном радикале, если на него, как и на метан действовать хлором при облучении ультрафиолетом:
Как можно заметить хлорирование толуола в присутствии хлорида алюминия привело к двум разным продуктам – орто- и пара-хлортолуолу. Это обусловлено тем, что метильный радикал является заместителем I рода.
Если хлорирование толуола в присутсвии AlCl3 проводить в избытке хлора, возможно образование трихлорзамещенного толуола:
Аналогично при хлорировании толуола на свету при большем соотношении хлор/толуол можно получить дихлорметилбензол или трихлорметилбензол:
Нитрование
Замещение атомов водорода на нитрогрппу, при нитровании толуола смесью концентрированных азотной и серной кислот, приводит к продуктам замещения в ароматическом ядре, а не метильном радикале:
Алкилирование
Как уже было сказано метильный радикал, является ориентантом I рода, поэтому его алкилирование по Фриделю-Крафтсу приводит продуктам замещения в орто- и пара-положения:
Реакции присоединения
Толуол можно прогидрировать до метилциклогексана при использовании металлических катализаторов (Pt, Pd, Ni):
С6Н5СН3 + 9O2 → 7СO2 + 4Н2O
Неполное окисление
При действии такого окислителя, как водный раствор перманганата калия окислению подвергается боковая цепь. Ароматическое ядро в таких условиях окислиться не может. При этом в зависимости от pH раствора будет образовываться либо карбоновая кислота, либо ее соль:
Окисление — ацетилен
Окисление ацетилена воздухом при очень низких концентрациях ацетилена имеет большое значение в промышленном получении жидкого кислорода.
На окисление ацетилена II, взятого в количестве 43 3 г, израсходовано 1940 мл кислорода, что соответствует образованию 7 6 г гидроперекиси.
|
Шлирен-фотографии волн детонации смесей С2Н2. О2. Аг 20. 45. 35 ( воспроизведены по работе. |
Процесс окисления ацетилена легко приобретает характер детонации. При этом по непрореагировавшему газу движется ударная волна, за фронтом которой реакция горения быстро достигает термодинамического равновесия. Модели профиля детонационной волны, рассмотренные в гл. VI в связи со взрывным разложением чистого ацетилена, применимы и для детонации при окислении ацетилена, как и для других газовых реакций. Скорость распространения детонационной волны определяется законами термодинамики и газодинамики, а не кинетикой реакции горения. Теория стационарной детонации в газах изложена в ряде монографий ( см., например ) и выходит за рамки настоящей книги, которая посвящена главным образом ацетилену.
При окислении ацетилена марганцовокислым калием в кислой и нейтральной среде образуются главным образом СО2 и муравьиная кислота, а в щелочной среде-сначала глико-левый альдегид СН2ОНСНО, затем щавелевая кислота НООС-СООН.
При исследовании кинетики окисления ацетилена в токе воздуха применялся метод диафрагм, состоящий в том, что реакционный сосуд разделялся диафрагмой-катализатором на две части.
Спенс , изучая окисление ацетилена в струевых условиях, нашел, что при уменьшении диаметра сосуда ниже 4 мм скорость реакции резко падала. Хиншельвуд и Форт при окислении метана констатировали, что скорость реакции пропорциональна третьей и даже четвертой степени диаметра сосуда.
Спенс , изучая окисление ацетилена при 320 и р 400 мм рт. ст., показал, что при уменьшении диаметра сосуда до 4 мм рт.ст. происходит резкое уменьшение скорости реакции.
Схема Льюиса и Эльбе окисления ацетилена вызывает некоторые сомнения. В связи с этим следует напомнить, что аналогичная реакция предполагается в качестве основного звена цепи и при окислении метана.
Кистяковский и Ленер изучали окисление ацетилена в струевых условиях при атмосферном давлении. Кроме продуктов, перечисленных в таблице, был обнаружен еще и глиоксаль.
|
Общий закон изменения функции т ( доли прореагировавше ] о исходного вещества от времени 6. Результаты трансформации экспериментальных кривых окисления метана, этана и бензола хорошо ложатся на теоретическую ( сплош. |
Таким образом и в случае окисления ацетилена характер изменения давления не может служить основанием для установления вырожденного разветвления в качестве кинетического механизма реакции. Цепной ее характер, однако, доказывается сильной зависимостью скорости реакции окисления во-первых, от набивки сосуда, во-вторых, от величины диаметра и, в-третьих, от добавок двуокиси азота.
Стеси и Макдональд , изучавшие окисление ацетилена в его эквимолекулярной смеси с кислородом в статических условиях при Т 320 С и Ртч 100 — 200 мм рт. ст., нашли, что кислород несколько ингиби-рует реакцию.
Особенно ярко выявилось это влияние в процессах окисления ацетилена и селективного окисления сероводорода. Естественно, что в промышленных условиях, когда применяют более крупные куски катализатора, большие размеры аппаратуры, часто повышенные давления, эти факторы должны проявляться еще сильнее. Весьма возможно, что одной из причин малой популярности теоретических исследований среди практиков является несоответствие результатов, полученных в лабораториях, данным, получаемым в промышленных установках, вследствие искажающего влияния макрокинетических явлений.
По форме эта реакция соответствует пол ному окислению ацетилена в углекислоту и воду.
Окисление — ацетилен
Синтетический способ получения уксусной кислоты основан на окислении ацетилена С2Н2 кислородом воздуха в присутствии солей окиси ртути, действующих как катализатор.
Описано несколько вариантов получения щавелевой кислоты при окислении ацетилена.
СН / ГзССН — 2 СН3СООН При окислении ацетилена образуется дикарбоновая кислота — щавелевая.
Фастовский и Малюсов изучили ряд катализаторов для окисления ацетилена.
Селективное каталитическое окисление окиси углерода протекает наряду с окислением ацетилена на гопкалите при 200 при наличии в газе некоторого избытка кислорода. Продуктом реакции является СОг. При применении метода каталитического окисления очистку от СО можно совместить с окислением ацетилена или ее можно провести отдельно после удаления ацетилена другими методами. Низкотемпературная ректификация может обеспечить получение этилена, свободного от СО, которая переходит в метановодо-родную фракцию.
|
Кинетическая изотерма обмена адсорбированного на NiO меченого ацетилена на обычный ацетилен и.. газовой фазы, измеренная при температуре 190 в координатах ig добм — lg L.| Кинетическая изотерма обмена адсорбированного на N10 меченого ацетилена на обычный ацетилен из газовой фазы, измеренная при температуре 245 в координатах lg / обы — lg t. |
При этой температуре исследование обмена несколько осложнено побочным процессом окисления ацетилена до СС2 с использованием кислорода N10, протекающим с измеримой скоростью.
Очевидно, чго присутствие кислоты в реакционной смеси способствует окислению ацетиленов диоксидом селена, однако н таких условиях нп: шшк.
|
Зависимость lg W — qs для полного окисления ацетилена ( W — скорость реакции ( моль / м2 сек при 220 С и составе смеси. 50 % О2, 2 % С2Н2, 48 % N2.| Зависимость lg W — qs для полного окисления метанола в избытке О2 ( W — скорость реакции ( моль / м2 сек при 300 С. |
На рис. 5 представлена зависимость lg W — qs для окисления ацетилена на окислах.
Большое число работ проведено по термическому ( не каталитическому) окислению ацетилена. Вследствие того, что этот метод не представляется практичным использовать для обсуждаемой цели из-за требуемых им относительно высоких температур, а также в связи с тем, что его механизм, повидимому, совершенно отличен от механизма гетерогенной реакции, авторы не собираются обсуждать его в данной статье. Однако несомненно, что каталитический процесс оказывается с точки зрения образующихся продуктов реакции более простым; при термической реакции, как правило, образуется перекись, приводящая к возникновению значительно более сложных молекул — альдегидов и спиртов, тогда как в конечных продуктах каталитического окисления обнаружены только углекислота и вода, хотя имеются некоторые основания подозревать, что в качестве промежуточных продуктов кратковременно могут присутствовать и другие вещества.
Ленер нашел, что окислы азота или азотная кислота способствуют окислению ацетилена кислородом в газовой фазе.
При очистке гератолем хромовый ангидрид в боль шей мере расходуется на окисление ацетилена, чем на окисление фосфористого водорода.
Экспериментальные данные позволяют сделать вывод, что при указанных условиях скорость окисления ацетилена двуокисью углерода мало отличается от скорости его окисления парами воды.
Самым важным в технологическом отношении моментом, где приходится сталкиваться с реакцией окисления ацетилена, можно считать применение его пламени для целей сварки и резки. Этот процесс, конечно, было бы правильнее назвать горением, нежели окислением в обычном химическом понимании этого слова. Полное сгорание ацетилена до углекислоты и воды представляет собой процесс весьма экзотермичный, при котором выделяется около 312 000 кал, на моль. Вследствие этого можно поднять температуру пламени ацетилена выше 3000 при условии применения хорошо сконструированной и правильно управляемой горелки.
Классификация и номенклатура
Названия этиленовые углеводороды по заместительной номенклатуре IUPAC образуют путем замещения суффикса -ан в названии соответствующего насыщенного углеводорода на -ен; положения двойной связи обозначают цифрой, при этом нумерация начинается с того конца цепи, к которому ближе расположен двойная связь:
СН3-СН = СН-СН 2 СН (СН 3) -СН3 — 5-метилгексен-2.
Для первых членов гомологического ряда более употребляемыми являются тривиальные названия — этилен, пропилен, бутилен и т.п., причем названии первого представителя «этилен», по правилам IUPAC, предоставляется преимущество перед названием «этен». Иногда используют рациональную номенклатуру, по которой углеводород рассматривают как производную этилена, в котором атомы водорода замещены на радикалы:
СН3-СН = СН2 — метилэтилен.
Для этиленовых углеводородов, начиная с С4Н8, характерная структурная изомерия (изомерия углеродного скелета, изомерия положения двойной связи), а также геометрическая (цис, транс) изомерия, что обусловлено значительным барьером вращения вокруг двойной связи. При нормальных условиях:
- первые четыре представителя алкенов — газы
- соединения С5-С17 — бесцветные жидкости
- далее следуют твердые вещества









