Состав, строение и свойства металлических сплавов
Содержание:
- Свойства сплавов
- Способы изготовления стали и технологии
- Какое количество вещества водорода выделится при взаимодействии цинка с соляной кислотой массой 146 г?
- Что такое воронение
- Внутреннее строение — сплав
- Свойства сплавов
- Слесарное дело
- § 2. Внутреннее строение металлов и сплавов
- Восстановительная активность — металл
- Диаграмма состояния
Свойства сплавов
Чтобы изготавливать детали и конструкции, нужно знать основные свойства металлов и сплавов. При неправильной обработке готовая деталь может быстро выйти из строя и разрушить оборудование.

Двигатель внутреннего сгорания
Физические свойства
Сюда относятся визуальные параметры и характеристики материала, изменяющиеся при обработке:
- Теплопроводность. От этого зависит насколько поверхность будет передавать тепло при нагревании.
- Плотность. По этому параметру определяется количество материла, которое содержится в единице объёма.
- Электропроводность. Возможность металла проводить электрический ток. Этот параметр называется электрическое сопротивление.
- Цвет. Этот визуальный показатель меняется под воздействием температур.
- Прочность. Возможность материала сохранять структуру при обработке. Сюда же относится твердость. Эти показатели относятся и к механическим свойствам.
- Восприимчивость к действию магнитов. Это возможность материала проводить через себя магнитные лучи.
Физические основы позволяют определить в какой сфере будет использоваться материал.
Химические свойства
Сюда относятся возможности материала противостоять воздействию химических веществ:
- Устойчивость к коррозийным процессам. Этот показатель определяет на сколько материал защищён от воздействия воды.
- Растворимость. Устойчивость металла к воздействию растворителей — кислотам или щелочным составам.
- Окисляемость. Параметр указывает на выделение оксидов металлом при его взаимодействии с кислородом.
Обуславливаются эти характеристики химическим составом материала.
Механические свойства
Механические свойства металлов и сплавов отвечают за целостность структуры материала:
- прочность;
- твердость;
- пластичность;
- вязкость;
- хрупкость;
- устойчивость к механическим нагрузкам.
Технологические свойства
Технологические свойства определяют способность металла или сплава изменяться при обработке:
- Ковкость. Обработка заготовки давлением. Материал не разрушается. Структура изменяется.
- Свариваемость. Восприимчивость детали к работе сварочным оборудованием.
- Усадка. Происходит этот процесс при охлаждении заготовки после её разогрева.
- Обработка режущим инструментом.
- Ликвация (затвердевание жидкого металла при понижении температуры).
Основной способ обработки металлических деталей — нагревание.
Свойства металлов и сплавов отвечают за то, как себя будет вести готовое изделие при эксплуатации
При обработке материалов также важно знать его характеристики
Способы изготовления стали и технологии
От технологии изготовления стали зависят структура этого сплава, его состав и свойства. Обычные стали производятся в мартеновских печах или конвертерах. Как правило, они насыщены значительным количеством неметаллических примесей.
Высококачественные сплавы производят с использованием электропечей. Особовысококачественные легированные стали, содержащие минимальное количество вредных примесей, производятся в процессе электрошлаковой переплавки.
При производстве сталей используют процесс раскисления, направленный на выведение кислорода из структуры сплава. От количества удалённого кислорода зависит, какие получаются стали: малораскисленные, совершенно раскисленные или полураскисленные. Их классифицируют, как кипящие, спокойные и полуспокойные.
Марки стали
Несмотря на то, что сталь однозначно признаётся самым востребованным сплавом железа, единая система маркировки её видов по настоящее время не сложилась. Наиболее проста и популярна буквенно-численная маркировка.
Качественные углеродистые стали маркируют с использованием литеры «У» и двузначным числовым значением (в сотых %) уровня углерода в их составе (У11).В марке обычных углеродистых сталей за буквой следует число, указывающее на количество углерода в десятых % — У8.
Литеры используются и в маркировке легированных сталей. Они указывают на основной элемент, применяемый для легирования. Идущая следом цифра показывает концентрацию данного элемента в составе стали. Перед литерой ставят цифру, соответствующую доле углерода в металле в сотых %.

Например, стоящая в конце марки высококачественного сплава буква «А» указывает на его качество. Эта же литера в середине марки уведомляет об основном элементе легирования, в данном случае им является азот. Литера в начале марки сообщает о том, что это автоматная сталь.
Литера «Ш» в конце маркировки, прописанная через дефис, говорит о том, что это особовысококачественный сплав. Качественные стали, не имеют в маркировке литер «А» и «Ш». Кроме того, существует дополнительная маркировка, указывающая на особые характеристики сталей. Так, например, магнитные сплавы отмечают литерой «Е», а электротехнические — «Э».
Буквенно-числовая маркировка, пожалуй, одна из самых простых и понятных для потребителя. Другие, более сложные, доступны только для специалистов.
Какое количество вещества водорода выделится при взаимодействии цинка с соляной кислотой массой 146 г?
Решение:
- Записываем уравнение реакции: Zn + 2HCl = ZnCl2 + H2↑
- Находим молярную массу соляной кислоты: M (HCl) = 1 + 35,5 = 36,5 (г/моль)
(молярную массу каждого элемента, численно равную относительной атомной массе, смотрим в периодической таблице под знаком элемента и
округляем до целых, кроме хлора, который берется 35,5) - Находим количество вещества соляной кислоты: n (HCl) = m / M = 146 г / 36,5 г/моль = 4 моль
- Записываем над уравнением реакции имеющиеся данные, а под уравнением — число моль согласно уравнению (равно коэффициенту перед веществом): 4 моль x моль
Zn + 2HCl = ZnCl2 + H2↑ 2 моль 1 моль - Составляем пропорцию:
4 моль — x моль
2 моль — 1 моль
(или с пояснением:
из 4 моль соляной кислоты получится x моль водорода,
а из 2 моль — 1 моль) - Находим x: x =
4 моль • 1 моль / 2 моль = 2 моль
Ответ: 2 моль.
Что такое воронение
Воронение — это процесс, при котором железо подвергают действию сильных окислителей, в результате чего металл покрывается не проницаемой для газов пленкой окислов, предохраняющей его от воздействия внешней среды.
Чаще всего это бывает магнитная окись Fe3О4, которая глубоко внедряется в слой металла и защищает его от окисления лучше всякой краски. Уральское кровельное железо, подвергнутое воронению, продержалось на кровле без ржавления более 100 лет. Чем лучше отполирован металл, тем плотнее и прочнее образованная на его поверхности пленка окислов.
Эмалирование — очень хороший вид защиты от коррозии различной посуды. Эмаль не поддается не только действию кислорода и воды, но даже сильных кислот и щелочей. К сожалению, эмаль весьма хрупка и при ударе и быстрой смене температур довольно легко трескается.
Очень интересными способами защиты металлов от коррозии являются цинкование, а также никелирование и лужение.
Цинкование — это покрытие металла слоем цинка (так защищают главным образом железо). При таком покрытии в случае нарушения поверхностной пленки цинка коррозии подвергается сначала цинк как более активный металл, но цинк хорошо сопротивляется коррозии, так как его поверхность покрыта не проницаемой для воды и кислорода защитной пленкой окиси.
При никелировании (покрытии никелем) и лужении (покрытии оловом) ржавление железа не происходит до тех пор, пока не нарушен слой покрывающего его металла. Как только он нарушается, начинается коррозия железа как наиболее активного металла. Но никель — металл, сравнительно мало подвергающийся коррозии, поэтому его пленка держится на поверхности очень долго. Лудят чаще всего медные предметы, и тогда гальваническая пара медь — олово всегда приводит к коррозии олова, а не меди, которая менее активна как металл. При лужении железа получают «белую жесть» для консервной промышленности.
Внутреннее строение — сплав
|
Кристаллические решетки. |
Внутреннее строение сплавов определяется той связью, которая возникает между составляющими их элементами.
Внутреннее строение сплавов значительно отличается от строения металлов и неметаллов, из которых они образованы. Этим объясняется и резкое отличие свойств сплавов от свойств исходных материалов.
|
Кристаллические решетки. |
Внутреннее строение сплавов определяется той связью, которая возникает между составляющими их элементами.
Изменение внутреннего строения сплава путем ввода различных химических элементов в процессе его плавки называется объемным легированием. Легирование может быть и поверхностным, осуществляемым путем диффузионного насыщения отливок. Химические элементы, специально вводимые в сплав в различных количествах с целью изменения его строения, состава и свойств, называются легирующими добавками.
Легирующие добавки изменяют внутреннее строение сплава в результате образования новых структурных составляющих и фаз. Легирующий элемент может вступить в соединение с другими элементами, образовать сложные твердые растворы, раствориться в металлической основе, образовать интерметаллические соединения, неметаллические фазы, присутствовать в виде самостоятельной фазы.
Металлографический метод испытаний позволяет изучать внутреннее строение сплавов и осуществляется макроскопическим и микроскопическим анализами.
Металлографический метод испытаний позволяет изучать внутреннее строение сплавов при помощи макроскопических и микроскопических анализов.
Термической обработкой называются процессы, связанные с нагревом и охлаждением, вызывающие изменения внутреннего строения сплава и, в связи с этим, изменения физических, механических и других свойств.
Термической обработкой называют процессы, связанные с нагревом и охлаждением, вызывающие изменение внутреннего строения сплава и, как следствие этого, изменение механических, физических и других свойств.
Термическая обработка представляет собой совокупность операций нагрева, выдержки и охлаждения, проводимых в определенной последовательности с целью изменения внутреннего строения сплава и получения нужных свойств.
Термическая обработка представляет собой совокупность операций нагрева, выдержки и охлаждения, проводимых в определенной последовательности с целью изменения внутреннего строения сплава и получения нужных свойств.
Диаграммы состояния являются обобщением большого числа наблюдений над составом и структурой сплавов, и знакомство с ними дает возможность лучше усвоить процессы изменения внутреннего строения сплавов и в твердом состоянии, что имеет важное значение во многих случаях, особенно при термической обработке.
Микроскопический анализ ( микроанализ) — исследование металлов при больших увеличениях ( до 2000 раз) при помощи металломикроскопов — применяют для определения химического состава некоторых составляющих и характера действия на них специальных веществ, участвующих в химической реакции; для выявления микропороков ( пористости, раковин, трещин) и изменений внутреннего строения сплава, происходящих под влиянием различных режимов термической и химикотермической обработки, а также после внешнего механического воздействия на сплав.
Свойства сплавов
Свойства металлов и сплавов полностью определяются их структурой (кристаллической структурой фаз и микроструктурой). Макроскопические свойства сплавов определяются микроструктурой и всегда отличаются от свойств их фаз, которые зависят только от кристаллической структуры. Макроскопическая однородность многофазных (гетерогенных) сплавов достигается за счёт равномерного распределения фаз в металлической матрице. Сплавы проявляют металлические свойства, например: электропроводность и теплопроводность, отражательную способность (металлический блеск) и пластичность. Важнейшей характеристикой сплавов является свариваемость.
Сплавы, используемые в промышленности
Сплавы различают по назначению: конструкционные, инструментальные и специальные.
Конструкционные сплавы:
· стали
· чугуны
· дюралюминий
Конструкционные со специальными свойствами (например, искробезопасность, антифрикционные свойства):
· бронзы
· латуни
Для заливки подшипников:
· баббит
Для измерительной и электронагревательной аппаратуры:
· манганин
· нихром
Для изготовления режущих инструментов:
· победит
В промышленности также используются жаропрочные, легкоплавкие и коррозионностойкие сплавы, термоэлектрические и магнитные материалы, а также аморфные сплавы.
Мета?ллы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Из 118 химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
— 6 элементов в группе щелочных металлов,
— 6 в группе щёлочноземельных металлов,
— 38 в группе переходных металлов,
— 11 в группе лёгких металлов,
— 7 в группе полуметаллов,
— 14 в группе лантаноиды + лантан,
— 14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний, вне определённых групп бериллий и магний.
Таким образом, к металлам, возможно, относится 96 элементов из всех открытых.
В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия.
Слесарное дело
§ 2. Внутреннее строение металлов и сплавов
Изучение внутреннего строения металлов и сплавов позволило ученым сделать вывод: изменения свойств металлов и сплавов определяются особенностями их внутриатомного строения. По современной теории строения атомов каждый атом состоит из положительно заряженного ядра и движущихся вокруг него с огромной скоростью отрицательно заряженных электронов.
Ядро, несмотря на незначительный его размер по сравнению с размерами атома, сосредоточивает в себе 99,98% всей массы атома. Ядро атома состоит из положительно заряженных элементарных частиц — протонов и нейтральных элементарных частиц — нейтронов.
Электроны вращаются по орбитам, находящимся на разном расстоянии от ядра. Наибольшее влияние на свойства элементов оказывают электроны, вращающиеся по внешней орбите, определяющие собой валентность элемента, почему эти электроны и получили название валентных. Число их на орбите может изменяться от 0 до 8.
В металлах свободные электроны непрерывно перемещаются между ионами, но не покидают поверхность металла.
В металлах и сплавах атомы объединяются в кристаллические решетки и располагаются в них в определенном порядке.
Тела, в которых атомы расположены хаотически, т. е. в беспорядке, называются аморфными. К ним относятся клей, пластмассы, стекло, смолы и др.
Кристаллические решетки металлов могут быть различных типов. На рис. 2 показано расположение атомов (ионов) в элементарных кристаллических решетках трех типов: кубической объемноцентрированной, кубической гранецентрированной и гексагональной.
Рис. 2. Элементарные кристаллические решетки:
а — кубическая объемно-центрированиая, б — кубическая гранецентрированная, в — гексагональная
Кубическая объемно-центрированная решетка представляет собой центрированный куб с девятью атомами, из которых восемь атомов размещены в вершинах куба и один в центре (рис. 2, а).
Кубическая с центрированными гранями решетка имеет четырнадцать атомов, расположенных по углам решетки и в центре каждой грани (рис. 2, б).
Гексагональная решетка (рис. 2, в) имеет семнадцать атомов, из которых двенадцать размещены в вершинах шестигранной призмы, два — в центре оснований и три — в среднем сечении.
Размеры кристаллической решетки характеризуются ее параметрами. Размер кубических кристаллических решеток определяется одним параметром — длиной ребра а куба, размер гексагональной кристаллической решетки — двумя параметрами а и с или отношением.
Многократная повторяемость кристаллических решеток образует кристалл.
Восстановительная активность — металл
Восстановительная активность металлов по отношнию к окислам и солям может заметно отличаться в зависимости от условий процесса. На первый взгляд ( оба процесса ведут к образованию ионов из атомов) эти ряды должны совпадать.
Восстановительная активность металлов возрастает и окислительная активность их ионов уменьшается в ряду or положительных значений по-теьциала — к отрицательным.
Восстановительная активность металлов возрастает, и окислительная активность их ионов уменьшается в ряду от положительных значений потенциала к отрицательным.
Восстановительная активность металлов возрастает от Li к Fr, что обусловлено увеличением радиусов атомов в этом направлении и низкими значениями энергий ионизации.
Восстановительная активность металлов побочной подгруппь убывает от меди к золоту.
Восстановительная активность металлов подгруппы VIB растет с уменьшением порядкового номера. Однако благодаря устойчивой оксидной пленке только хром является пассивным металлом в широком интервале температур. Молибден и вольфрам начинают окисляться на воздухе при 250 — 400 С. Оксиды летучи ( особенно МоО3), пленки их на металлах не защищают от дальнейшего окисления. Использование изделий из этих металлов при высокой температуре требует создания водородной или инертной среды. Хром окисляется при нагревании только в виде порошка. Сплавы железа с хромом ( и никелем) нержавеющие. Молибден и вольфрам поглощают водород только при 1200 С и выше, а при охлаждении его содержание в металлах уменьшается. Хром с водородом образует неустойчивые гидриды СгН и СгН2, разлагающиеся при нагревании. Хром, молибден и вольфрам не реагируют со ртутью и не образуют амальгам. При нагревании с углеродом и углеводородами до 1200 — 1400 С образуют карбиды V2C, WC, Мо2С, МоС ( являющиеся фазами переменного состава) и различные карбиды хрома. Эти металлы образуют силициды, бориды, сульфиды, фосфиды, нитриды различного состава. Нитриды весьма тверды, но не очень химически устойчивы, карбиды же в обычных условиях довольно устойчивы.
Восстановительная активность металлов побочной подгруппы убывает от меди к золоту.
Чем объясняется более низкая восстановительная активность металлов, относящихся к подгруппе кальция, по сравнению со щелочными металлами.
В этом ряду восстановительная активность металлов в водных растворах сверху вниз уменьшается: металлы, стоящие в начале ряда, легко отдают электроны и превращаются в положительно заряженные ионы; металлы, стоящие в конце ряда, с трудом отдают электроны. И наоборот, окислительная способность катионов металлов сверху вниз увеличивается.
В этом ряду восстановительная активность металлов в водных растворах сверху ьниз уменьшается: металлы, стоящие в начале ряда, легко отдают электроны и превращаются в положительно заряженные ионы; металлы, стоящие в конце ряда, с трудом отдают электроны. И наоборот, окислительная способность катионов металлов сверху вниз увеличивается.
Эффективность процесса окисления зависит от восстановительной активности металла и характеризуется величиной теплоты образования получающегося оксида.
|
Природные смеси изотопов цинка, кадмия и ртути. |
Если щелочноземельные металлы относятся к числу сильных восстановителей, то восстановительная активность металлов группы цинка значительно ниже: цинк и кадмий — средние восстановители, а ртуть — слабый.
Продукт, до которого восстанавливается кислота, зависит как от восстановительной активности металла, так и от окислительных свойств самой кислоты. Например, концентрированная серная кислота, взаимодействуя с медью, восстанавливается до двуокиси серы, с цинком — до свободной серы и с кальцием — до сероводорода.
Анализируя рис. 38.11, можно заметить следующие особенности: 1) уменьшение восстановительной активности металлов группы IIIA ( кроме бора) по направлению от А1 к Т1; 2) широкая область устойчивости состояния 1 для Т1; 3) умеренное ( немонотонное) изменение кислотности ионов М ( водн), измеряемое величиной рН равновесия с М ( ОН) 3 ( кр); 4) понижение кислотности М ( ОН) з ( кр) в ряду от А1 ( ОН) 3 к Т1 ( ОН) 3, измеряемое увеличением значения рН, при котором твердая гидроокись растворяется в основных растворах
Обратите также внимание, что ион Т13 имеет значительно более выраженные кислотные свойства, чем Т17, в соответствии с различием в их плотности зарядов.
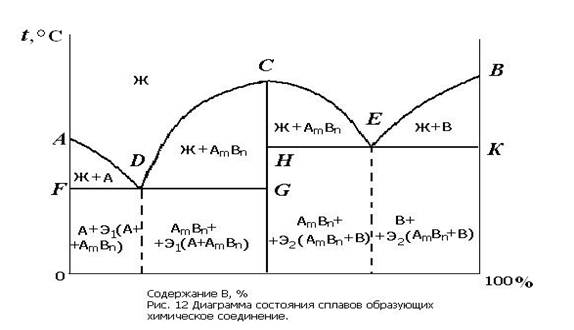
Диаграмма состояния
Диаграмма состояния показывает строение сплава в зависимости от соотношения компонентов и от температуры. Она строится экспериментально по кривым охлаждения сплавов (рис. 8). В отличие от чистых металлов сплавы кристаллизуются не при постоянной температуре, а в интервале температур. Поэтому на кривых охлаждения сплавов имеется две критические точки. В верхней критической точке, называемой точкой ликвидус (tл), начинается кристаллизация. В нижней критической точке, которая называется точкой солидус (tc), кристаллизация завершается. Кривая охлаждения механической смеси (рис. 8, а) отличается от кривой охлаждения твердого раствора (рис. 8, б) наличием горизонтального участка. На этом участке происходит кристаллизация эвтектики.
Эвтектикой называют механическую смесь двух фаз, одновременно кристаллизовавшихся из жидкого сплава. Эвтектика имеет определенный химический состав и образуется при постоянной температуре.

Диаграмму состояния строят в координатах температура-концентрация. Линии диаграммы разграничивают области одинаковых фазовых состояний. Вид диаграммы зависит от того, как взаимодействуют между собой компоненты. Для построения диаграммы состояния используют большое количество кривых охлаждения для сплавов различных концентраций. При построении диаграммы критические точки переносятся с кривых охлаждения на диаграмму и соединяются линией. В получившихся на диаграмме областях записывают фазы или структурные составляющие. Линия диаграммы состояния на которой при охлаждении начинается кристаллизация сплава называется линией ликвидус, а линия на которой кристаллизация завершается — линией солидус.
Виды диаграмм состояния
Диаграмма состояния сплавов, образующих механические смеси (рис. 9), характеризуется отсутствием растворения компонентов в твердом состоянии. Поэтому в этом сплаве возможно образование трех фаз: жидкого сплава Ж, кристаллов А и кристаллов В. Линия АСВ диаграммы является линией ликвидус: на участке АС при охлаждении начинается кристаллизация компонента А, а на участке СD — компонента В. Линия DСВ является линией солидус, на ней завершается кристаллизация А или В и при постоянной температуре происходит кристаллизация эвтектики Э. Сплавы концентрация которых соответствует точке С диаграммы называются эвтектическими, их структура представляет собой чистую эвтектику.
Сплавы, расположенные на диаграмме левее эвтектического, называются доэвтектическими, их структура состоит из зерен А и эвтектики. Те сплавы которые на диаграмме расположены правее эвтектического, называются заэвтектическими, их структура представляет собой зерна В, окруженные эвтектикой.

Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии изображена на рис. 10. Для этого сплава возможно образование двух фаз: жидкого сплава и твердого раствора а. На диаграмме имеется всего две линии, верхняя является линией ликвидус, а нижняя — линией солидус.
Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии показана на рис 11. В этом сплаве могут существовать три фазы — жидкий сплав, твердый раствор α компонента В в компоненте А и твердый раствор β компонента А в компоненте В. Данная диаграмма содержит в себе элементы двух предыдущих. Линия АСВ является линией ликвидус, линия АDСЕВ — линией солидус. Здесь также образуется эвтектика, имеются эвтектический, доэвтектический и заэвтектический сплавы. По линиям FD и EG происходит выделение вторичных кристаллов αIIи βII(вследствие уменьшения растворимости с понижением температуры). Процесс выделения вторичных кристаллов из твердой фазы называется вторичной кристаллизацией.

Диаграмма состояния сплавов, образующих химическое соединение (рис. 12) характеризуется наличием вертикальной линии, соответствующей соотношением компонентов в химическом соединении АmВn. Эта линия делит диаграмму на две части, которые можно рассматривать как самостоятельные диаграммы сплавов, образуемых одним из компонентов с химическим соединением. На рис. 12 изображена диаграмма для случая, когда каждый из компонентов образует с химическим соединением механическую смесь.