Ферритная фаза
Содержание:
- Литература
- Термодинамические фазы и агрегатные состояния вещества
- Твердые растворы замещения и внедрения; промежуточные фазы; сверхструктуры
- Описание
- 4. Промежуточные соединения
- Термодинамические фазы на фазовой диаграмме
- 3. Химическое соединение
- Избыточная фаза
- Основные понятия
- Фазовый состав — сплав
- Диаграмма состояния для сплавов, образующих химические соединения
Литература
- Базаров И. П. Термодинамика. — 5-е изд. — СПб.—М.—Краснодар: Лань, 2010. — 384 с. — (Учебники для вузов. Специальная литература). — ISBN 978-5-8114-1003-3.
- Герасимов Я. И., Древинг В. П., Еремин Е. Н. и др. Курс физической химии / Под общ. ред. Я. И. Герасимова. — 2-е изд. — М.: Химия, 1970. — Т. I. — 592 с.
- Мюнстер А. Химическая термодинамика / Пер. с нем. под. ред. чл.-корр. АН СССР Я. И. Герасимова. — М.: Мир, 1971. — 296 с.
- Сивухин Д. В. Общий курс физики. — Т. II. Термодинамика и молекулярная физика. — 5 изд., испр.. — М.: ФИЗМАТЛИТ, 2005. — 544 с. — ISBN 5-9221-0601-5.
- Термодинамика. Основные понятия. Терминология. Буквенные обозначения величин / Отв. ред. И. И. Новиков. — АН СССР. Комитет научно-технической терминологии. Сборник определений. Вып. 103. — М.: Наука, 1984. — 40 с.
Термодинамические фазы и агрегатные состояния вещества
Набор термодинамических фаз вещества обычно значительно богаче набора агрегатных состояний, то есть одно и то же агрегатное состояние вещества может находиться в различных термодинамических фазах. Именно поэтому описание вещества в терминах агрегатных состояний довольно огрублённое, и оно не может различить некоторые физические разные ситуации.
Богатый набор термодинамических фаз связан, как правило, с различными вариантами порядка, которые допускаются в том или ином агрегатном состоянии.
- В газообразном состоянии вещество не обладает никаким порядком. Соответственно, в газообразном состоянии любое вещество обладает только одной термодинамической фазой. (Фазовые переходы типа диссоциации молекул или ионизации являются, по определению, переходами одного вещества в другое).
- Жидкость обладает ориентационным порядком, но, как правило, не обладает трансляционным порядком. В результате у одной и той же жидкости могут быть разные термодинамические фазы, однако количество их редко превышает единицу. Так, например, существование новой жидкой фазы обнаружено в переохлаждённой воде. Другой пример — сверхтекучее состояние в жидком гелии.
- Кристаллическое твёрдое тело обладает как трансляционным, так и ориентационным порядком. В результате возникает большое число возможных вариантов ориентации соседних молекул друг относительно друга, которые могут оказаться энергетически выгодными при тех или иных давлении и температуре. В результате твёрдые тела обладают, как правило, достаточно сложной фазовой диаграммой. Например, фазовая диаграмма такого, казалось бы, простого вещества, как лёд, насчитывает по крайней мере 12 термодинамических фаз, реализующихся при различных температурах и давлениях.
Твердые растворы замещения и внедрения; промежуточные фазы; сверхструктуры
Твердые растворы – это фазы, в которых один из компонентов сплава сохраняет свою кристаллическую решетку, а атомы других компонентов располагаются в решетке первого компонента, изменяя ее размеры (периоды). Твердый раствор, который состоит из двух компонентов, имеет один тип решетки и представляет одну фазу.
Различают твердые растворы замещения и твердые растворы внедрения. При образовании твердого раствора замещения атомы растворенного компонента замещают часть атомов растворителя в его кристаллической решетке.
При кристаллизации чистого металла в системе имеются две фазы: жидкая (расплавленный металл) и твердая (зерна затвердевшего металла). В твердых сплавах фазы – это зерна чистого металла, зерна твердого раствора и зерна химического соединения.
Все металлы в жидком состоянии растворяются один в другом в любых соотношениях. В результате растворения образуется однородный жидкий раствор с равномерным распределением атомов одного металла среди атомов другого металла.
Некоторые металлы, сильно различающиеся размерами атомов, не растворяются в жидком состоянии, а немногие металлы растворяются в жидком состоянии ограниченно.
При образовании сплавов в процессе их затвердевания возможно различное взаимодействие компонентов.
Если в процессе кристаллизации сила взаимодействия между однородными атомами окажется больше силы взаимодействия между разнородными атомами, то после кристаллизации образуется механическая смесь, состоящая из зерен чистых металлов. В этом случае в твердом сплаве будут присутствовать зерна одного чистого металла и рядом с ними зерна другого чистого металла. Такая форма взаимодействия возникает при большом различии в свойствах входящих в сплав металлов.
Другой формой взаимодействия между веществами, входящими в состав сплава, является образование твердых растворов.
Твердыми растворами называют такие твердые фазы, в которых соотношения между компонентами могут изменяться. В твердом растворе так же, как и в чистых металлах, атомы в пространстве расположены закономерно, образуя кристаллическую решетку. Этим они и отличаются от жидких растворов. В твердом растворе одно из входящих в состав сплава веществ сохраняет присущую ему кристаллическую решетку, а второе вещество, утратив свое кристаллическое строение, в виде отдельных атомов распределяется в кристаллической решетке первого. Первое вещество является растворителем, а второе – растворимым. В зависимости от характера21б распределения атомов растворимого элемента различают твердые растворы внедрения, замещения и вычитания. Независимо от типа твердого раствора общим для них является то, что они однофазны и существуют в интервале концентраций. Для твердых растворов характерны металлические связи. В твердых растворах внедрения атомы растворимого элемента распределяются в кристаллической решетке металла-растворителя, занимая места между его атомами.
Ранее было отмечено, что у металлов атомы в кристаллической решетке располагаются близко один к другому и пустоты между ними имеют малые размеры. Разместиться в таких пустотах могут только атомы с очень малыми размерами.
Описание
В двухкомпонентной (или бинарной) системе эвтектическое равновесие можно выразить:
- α+β⇔L,{\displaystyle \alpha +\,\!\beta \Leftrightarrow L,}
- где L{\displaystyle L} — жидкая фаза (расплав, или раствор, например, «водный раствор»);
- α{\displaystyle \alpha } — твёрдый раствор компонента B{\displaystyle B} в кристаллической решётке, образованной компонентом A{\displaystyle A};
- β{\displaystyle \beta } — твёрдый раствор компонента A{\displaystyle A} в кристаллической решётке, образованной компонентом B{\displaystyle B}.
Добавляя или отводя тепло, можно изменить пропорцию между суммарным объёмом кристаллических фаз и расплавом в эвтектической точке при около эвтектической температуре.
Температура системы при этих процессах будет отличаться от равновесной (в подавляющем большинстве практических случаев очень незначительно — на десятые или сотые доли градуса Цельсия), так как для фазовых превращений (кристаллизации или плавления) необходим термодинамический стимул — переохлаждение или перегрев.
Процесс кристаллизации:
- L→α+β.{\displaystyle L\rightarrow \,\!\alpha +\,\!\beta .}
После кристаллизации эвтектика становится смесью кристаллитов фаз, очень часто сильно разветвлённых, взаимно проросших в процессе эвтектической кристаллизации. Одновременное образование нескольких кристаллических фаз в ходе эвтектической кристаллизации обусловливает возможность их кооперативного роста, при выполнении дополнительных условий, прежде всего, частичной кристаллографической согласованности решёток эвтектических фаз. В результате последнего образуются эвтектические бикристаллы (в случае двухкомпонентных, а также квазибинарных систем) — разветвлённые взаимновложенные дендриты эвтектических фаз, лишь выглядящие в сечении как мелкодисперсная смесь.
Эвтектика является пересечением поверхностей равновесия расплава с соответствующими (эвтектическими) фазами. Если отводится соответствующее количество тепла, то расплав эвтектического состава при кристаллизации в условиях близких к равновесным даст все кристаллические фазы, участвующие в равновесии. Если же подводится тепло в достаточном количестве, то смесь фаз, отвечающая эвтектическому составу, в условиях близких к равновесным будет плавиться с одновременным уменьшением доли каждой из кристаллических фаз вплоть до их полного исчезновения.
4. Промежуточные соединения
Значительное количество соединений, образуется в сплавах металлов не подчиняется законам валентности и не имеет устойчивого соотношения компонентов. Важнейшие промежуточные соединения, образующиеся в сплавах следующие:
- фазы укоренения;
- электронные соединения;
- гетерогенные структуры.
4.1. Фазы укоренения
Переходные металлы Fe, Mn, Cr, Mo и др.. образуют с элементами с малыми атомными радиусами углеродом, азотом, бором и водородом такие соединения как карбиды, нитриды, бориды и гидриды. Они имеют много общего в строении и свойствах, их часто называют фазами укоренения.
Фазы укоренения имеют формулу: M 4 X (Fe 4 N, Mn 4 N и др.)., M 2 X (Fe 2 N, W 2 C, Mo 2 C и др.)., MX (VC, TiN и др.). . Фазы укоренения являются фазами переменного состава, и имеют высокую твердость.
Упомянутые выше твердые растворы укоренения образуются при значительно меньших концентрациях второго компонента (C, N, H) и имеют решетку металла растворителя, тогда как фазы укоренения имеют другую решетку. Кристаллическая структура фаз укоренения определяется соотношением атомных радиусов неметалла (R x) и металла (R м). Если R x / R м то атомы металла в этих фазах размещены по типу одной из простых кристаллических решеток (кубической или гексагональной), в которую внедряются атомы неметалла, занимая в ней определенные места. Если условие R x / R м не выполняется, как это наблюдается у карбидов железа, марганца, хрома то образуются сложные решетки и такие соединения уже не относятся к фазам укоренения.
4.2. Электронные соединения
Электронные соединения образуются между одновалентными элементами (Cu, Ag, Au, Li, Na) или металлами переходных групп (Fe, Mn, Co и др.). И простыми металлами с валентностью от 2 до 5 (Be, Mg, Zn, Cd, Al и др..).
Электронные соединения имеют кристаллическую решетку, которая отличается от кристаллических решеток их компонентов и образуют сплавы в широком интервале концентраций.
Такие соединения имеют определенную электронную концентрацию (определенное отношение числа валентных электронов к числу атомов):
- для соединений с электронной концентрацией 3/2 (1,5) характерна обьемоцентрована кристаллическая решетка и называют ее β-соединение (CuBe, Cu 3 Al, FeAl и др..)
- для соединений с отношением 21/13 (1,62) характерна сложная кубическая решетка и обозначаются как γ-соединения (Cu 5 Zn 8, Fe 5 Zn 21 и др.).
- для соединений с электронной концентрацией 7/4 (1,75) характерна плотноупакованной гексагональная решетка и обозначается как ε-фаза (Cu 3 Si, Cu 3 Sn и др.)..
4.3. Гетерогенные структуры
При кристаллизации многих сплавов (в т.ч. и Fe-C) образуются структуры, состоящие из нескольких фаз, образующих эту гетерогенную структуру, которую проявляют микроанализом.
Термодинамические фазы на фазовой диаграмме
Типичные виды фазовых диаграмм. Зелёная линия из точек показывает аномальное поведение воды
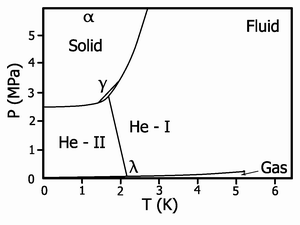 Фазовая диаграмма гелия-4
Фазовая диаграмма гелия-4
На фазовой диаграмме вещества различные термодинамические фазы занимают определённые области. Линии, разделяющие различные термодинамические фазы, называются линиями фазового перехода. Если вещество находится в условиях, отвечающих точке внутри какой-либо области, то оно полностью находится в этой термодинамической фазе. Если же состояние вещества отвечает точке на одной из линий фазовых переходов, то вещество в термодинамическом равновесии может находиться частично в одной, а частично в другой фазе. Пропорция двух фаз определяется, как правило, полной энергией, запасённой системой.
При медленном изменении давления или температуры вещество описывается движущейся точкой на фазовой диаграмме. Если эта точка в своём движении пересекает одну из линий, разделяющих термодинамические фазы, происходит фазовый переход, при котором физические свойства вещества меняются скачкообразно.
Не все фазы полностью отделены друг от друга линией фазового перехода. В некоторых случаях эта линия может обрываться, оканчиваясь критической точкой. В этом случае возможен постепенный, а не скачкообразный переход из одной фазы в другую, в обход линии фазовых переходов.
Точка на фазовой диаграмме, где сходятся три линии фазовых переходов, называется тройной точкой. Обычно под тройной точкой вещества подразумевается частный случай, когда сходятся линии плавления, кипения и сублимации, однако на достаточно богатых фазовых диаграммах может быть несколько тройных точек. Вещество в тройной точке в состоянии термодинамического равновесия может частично находиться во всех трёх фазах. На многомерных фазовых диаграммах (то есть если кроме температуры и давления присутствуют иные интенсивные величины) могут существовать четверные и прочие точки.
3. Химическое соединение
Характерными особенностями химических соединений образованных по закону нормальной валентности, что отличает от твердых растворов являются:
- кристаллическая решетка соединения отличается от кристаллических решеток компонентов;
- в соединении всегда сохраняется кратное массовое соотношение компонентов, что позволяет выразить ее простой формулой вида A n B m;
- свойства соединения резко отличаются от свойств компонентов, что ее создали.
- температура плавления стала.
В отличие от твердых растворов химические соединения образуются при существенной разнице в атомной и кристаллические строении компонентов.
Химические соединения металлов называются интерметаллиды (интерметаллических соединений)
Избыточная фаза
|
Блочная структура аустенита стали 15ХШ1Ф ( вакуумное травление после нагрева ниже ( а и выше ( б точки Ь Чернова. X 15000 X 2. |
Избыточные фазы и перераспределение легирующих элементов на границе раздела а — у, конечно, могут оказать задерживающее влияние на измельчение зерна. Это показано в работах Н.Н. Липчина и в других исследованиях. Однако физическая сущность процессов, приводящих к измельчению зерна в однородной 7-области, заключается в рекристаллизации аустенита. В этой связи правильнее говорить не о точке, а об интервале, в котором происходит рекристаллизация. Поэтому термин точка Ъ Чернова носит несколько условный характер и соответствует верхней границе интервала рекристаллизации.
|
Блочная структура аустенита стали 15ХШ1Ф ( вакуумное травление после нагрева ниже ( а и выше ( б точки Ъ Чернова. X 15000 X 2. |
Избыточные фазы и перераспределение легирующих элементов на границе раздела а — j, конечно, могут оказать задерживающее влияние на измельчение зерна. Это показано в работах Н.Н. Липчина и в других исследованиях. Однако физическая сущность процессов, приводящих к измельчению зерна в однородной 7 — бласти, заключается в рекристаллизации аустенита. В этой связи правильнее говорить не о точке, а об интервале, в котором происходит рекристаллизация. Поэтому термин точка Ъ Чернова носит несколько условный характер и соответствует верхней границе интервала рекристаллизации.
|
Микроструктура эвтектики системы Сц — Cu3P. X600.| Диаграмма состояния сплавов Си-CusP.| Микроструктура отожженной углеродистой стали эвтектоид-ного состава ( 0 8 % С. X 600.| Диаграмма состояния сплавов из двух компонентов с ограниченной и уменьшающейся с понижением температуры растворимостью в твердом состоянии. |
Избыточные фазы, выделяющиеся из твердого раствора, имеют разнообразную форму ( рис. 15), например игольчатую, зернистую или весьма часто в виде оторочки ( сетки) по границам зерен. Формы выделений и свойства избыточной фазы в значительной степени влияют на свойства всего сплава.
Избыточные фазы, выделяющиеся из твердого раствора, имеют разнообразную форму ( фиг.
Характерными избыточными фазами нержавеющих сталей, практически постоянно в них присутствующими, являются карбиды.
|
Микроструктура магниевого сплава ( 7 % Al. X250. |
Эти избыточные фазы присутствуют и в деформируемых сплавах с меньшим содержанием алюминия.
Если избыточная фаза является химическим соединением — твердым, но хрупким, то выделение ее в в иде сетки ( фрг.
Растворение избыточных фаз обычно происходит при нагреве, когда растворимость компонентов друг в друге увеличивается. Мелкие включения растворяются раньше крупных. Растворение избыточной фазы связано с переходом атомов растворенного компонента через межфазную поверхность и с последующей диффузией их в растворе. Во многих случаях удаление растворенных атомов от межфазной поверхности скомпенсировано поступлением атомов растворителя, так что растворившаяся часть избыточной фазы имеет состав и плотность упаковки твердого раствора. Однако в общем случае потоки атомов могут быть и нескомпенсированными. Удаление, например, растворенных атомов при трансформации избыточной фазы в твердый раствор может происходить быстрее, чем доставка атомов растворителя в превращенную область. Если в указанных случаях зарождение пор и не происходит, избыточные вакансии оседают на дислокациях и границах или формируют призматические петли дислокаций или тетраэдры дефектов упаковки. Рассмотренные факторы, наряду с образованием дефектов в связи с появлением концентрационных градиентов в диффузионной зоне, ведут к повышению плотности дислокаций.
|
Микроструктура литых сплавов. |
Выделения избыточной фазы имеют форму игл-пластин, ориентированных по определенным кристаллографическим направлениям в теле зерна, образуя видманштеттовую структуру, а также идущих вдоль границы зерен. С увеличением содержания углерода от 0 06 до 0 13 % заметно укрупнение пластин выделений.
Выделение избыточных фаз повышает жаропрочность лишь при условии сохранения достаточно высокой легированности твердого раствора. При значительном обеднении твердого раствора и укрупнении избыточной фазы жаропрочность сплава понижается. Старение должно проводиться при температурах, превышающих рабочую температуру в условиях эксплуатации.
Основные понятия
Газ всегда состоит из одной фазы, жидкость может состоять из нескольких жидких фаз разного состава (ликвация, жидкостная несмешиваемость), но двух разных жидкостей одного состава в равновесии сосуществовать не может (жидкий гелий — исключение). Вещество в твердом состоянии может состоять из нескольких фаз, причем некоторые из них могут иметь одинаковый состав, но различную структуру (полиморфные модификации, аллотропия).
Разные фазы обладают различными вариантами упаковки молекул (для кристаллических фаз, различными кристаллическими решетками), и, следовательно, своими характерными значениями коэффициента сжимаемости, коэффициента теплового расширения и прочими характеристиками. Кроме того, различные фазы могут обладать разными электрическими (сегнетоэлектрики), магнитными (ферромагнетики), и оптическими свойствами (например, твёрдый кислород).
Фазовый состав — сплав
|
Зависимость твердости Со-Ni — покрытий от температуры отжига.| Зависимость коэрцитивной силы от содержания никеля в Со-Ni — Р — покрытиях. |
Фазовый состав сплавов после термообработки при 450 — 550 С зависит от содержания никеля и кобальта в составе покрытия.
Фазовый состав сплавов, как уже указывалось, может резко снижать пластичность и вызывать хрупкое состояние как при холодной, так и при горячей обработке давлением.
Фазовый состав сплава окончательно еще не установлен.
|
Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии. а — фазовая. б — структурная. dde. d Ь — конода. |
Фазовый состав сплавов в любой области диаграммы состояния легко определить с помощью коноды — горизонтального отрезка, концы которого ограничены равновесными сосуществующими фазами и содержанием в них компонентов ( рис. 17, д, линия a. Согласно этому правилу для определения массового или объемного количества фазы необходимо вычислить отношение длины отрезка коноды, прилегающего к составу альтернативной фазы, к длине всей коноды.
|
Зависимость коэрцитивной силы от содержания никеля в Со-Nt — Р покрытиях. |
Фазовый состав сплавов после термообработки при 450 — 550 С зависит от содержания никеля и кобальта в составе покрытия.
Фазовый состав сплава в литом состоянии: а-твердый раствор Si Mg2Si CuAl2 Al3Ti W ( AlxMg5Cu4Si4); отличается от сплава АЛ4 более высокой прочностью при комнатной температуре и повышенной жаропрочностью.
Фазовый состав сплава ВТ9 в термоупрочненном состоянии отличается от фазового состава в отожженном состоянии. Последующий нагрев при температурах до 400 С приводит к дораспаду р-фазы и сплав имеет следующий состав: a ( a) — f — a — При повышении температуры до 450 — 550 С — фаза распадается, и механические свойства изменяются ( увеличивается прочность и снижается пластичность) ( рис. 90), достигая экстремальных значений при 550 С.
Фазовый состав сплава в литом состоянии: а-твердый раствор Si Mg2Si CuAl2 Al3Ti W ( AlxMg5Cu4Si4); отличается от сплава АЛ4 более высокой прочностью при комнатной температуре и повышенной жаропрочностью.
Фазовый состав сплава ( NaPOu — NaiPtO1) 1: 1 ( мол.
|
Зависимость отложения продуктов карамелнзации от температуры гидрогенолиза. |
Фазовый состав сплава Си: А1 ( 60: 40) качественно тот же, что и у предыдущего, но, судя по интенсивностям линий, соотношение CuAlj / CugAU возрастает.
Изменения фазового состава сплавов могут происходить строго по описанной схеме только при условии, что во всем объеме сплава температура в любой момент времени совершенно одинакова, а каждая из фаз имеет совершенно однородный состав. Такое условие может быть выполнено лишь при бесконечно малой скорости охлаждения. В реальной обстановке охлаждение происходит с достаточно большой скоростью, поэтому в сплавах рассматриваемого типа в ходе кристаллизации не в полной мере успевают проходить диффузионные процессы, которые должны обеспечивать постоянство состава во всем объеме жидкости и кристаллов. Следствием этого отставания является дендритная ликвация — микронеоднородность состава в пределах одного кристалла.
Диаграмма состояния для сплавов, образующих химические соединения
Данная диаграмма образуется, когда сплавляемые компоненты образуют устойчивое химическое соединение АтВп , не диссоциирующее при нагреве вплоть до температуры плавления.

Рис. 6. Диаграмма состояния с устойчивым химическим соединением
На рис. 6 показана диаграмма состояния для сплавов, образующих химическое соединение.
При концентрации, соответствующей химическому соединению АnВm , отмечается характерный перелом на кривой свойств. Это объясняется тем, что некоторые свойства химических соединений обычно резко отличаются от свойств образующих их компонентов.
В данном случае химическое соединение АтВп образует с компонентами А и В сплавы, относящиеся к диаграмме состояний на рис. 6. Структурный состав любого сплава системы А-В в твердом состоянии должен представлять смесь химического соединения и одного из исходных компонентов.









