Какая температура плавления у олова, свойства элемента
Содержание:
Плотность — олово
Плотность олова 7 31 кг / дмя; температура плавления Ц-232 С; температура кипения — ( — 2275 С; олово обладает высокой стойкостью по отношению к коррозии многими химическими соединениями, хотя и поддается действию силь-ных кислот.
Плотность олова в жидком состоянии характеризуется приведенными ниже цифрами.
Плотность олова 7.31 кг / дм3, температура плавления 4 — 232 С, температура кипения 4 — 2 275 С; олово обладает высокой стойкостью по отношению к коррозии многими химическими соединениями, хотя и поддается действию сильных кислот.
Плотности жидкого и твердого олова при температуре плавления ( 231.9 С) равны 6.980 г-см 3 и 7.184 г-см, соответственно.
Для проверки правильности работы экспериментальной установки было проведено измерение плотности олова в твердом и жидком состояниях.
Определить приращение объема при расплавлении 10 кг олова, если теплота плавления его равна 59 41 Дж / г, температура плавления 232 С, плотность твердого олова 7 18 г / см3, d7YdP 3 256 — 10 — 8 кПа — — К.
Определить приращение объема при расплавлении 10 кг олова, если теплота плавления его равна 59 41 Дж / г, температура плавления 232 С, плотность твердого олова 7 18 г / см3, d7 / dP 3 256 — 10 — 8 кПа — К.
Определить удельный объем жидкого олова при температуре плавления 232 С ( р атм), если удельная теплота плавления его равна 59 413 Дж / г, плотность твердого олова 7 18 г / см3, dT / dP 3 2567 Ю-8 кПа — К.
Определить удельный объем жидкого олова при температуре плавления 232 С ( р1 атм), если удельная теплота плавления его равна 59 413 Дж / г, плотность твердого олова 7 18 г / см3, dT / dP 3 2567 1 0 8 кПа — — К.
Алюминий по многим показателям выгодно отличается от олова. Если учесть разницу в плотности олова ( 7300 кг / м3) и алюминия ( 2700 кг / м3), то становится ясным, какой эффект может быть достигнут при замене лужения алюминированием. Хотя стоимость металла составляет только часть общей стоимости нанесения, но именно она играет решающую роль в оценке экономичности всего процесса.
|
Температура затвердева. |
Большой интерес представляют результаты исследований сжимаемости металлов при давлениях в несколько миллионов атмосфер, достигаемых путем ударного сжатия. Плотность железа, никеля и меди возросла при этом приблизительно вдвое, а плотность олова и свинца — более чем в 2 5 раза.
Применяя ударное сжатие, можно получить давление в несколько миллионов атмосфер. Так, при давлении 9 12 — Ю8 кн / м2 ( 9 млн. атм) плотность железа, никеля и меди увеличивается примерно вдвое, а плотность олова и свинца более чем в 2 5 раза.
Физико — химические свойства олова
Чистое олово — серебристо — белый блестящий металл с плотностью 7,3 г/см3 и температурой плавления 231,9°C . Белое олово ( обычное ) устойчиво при температуре выше + 13°C . При низких температурах , например во время сильных морозах , белое олово легко превращается в серое . Соединения олова известны с различными степенью окисления — +2 , +4 .
Олово медленно растворяется в разбавленных соляной кислоте и серной кислоте , так как в электрохимическом ряду напряжений стоит почти рядом с водородом ( влево от него ) .Олово растворяется в концентрированной соляной кислоте и хлоре но очень медленно :
Sn + 2Cl2 → SnCl4
Sn + 4HCl → H2 + H2
В реакции с азотной кислотой олово ведёт себя по разному в зависимости от концентрации кислоты , с концентрированной образуется оловянная кислота H2SnO3 ( или метаоловянная кислота )
Sn + 4HNO3 → SnO2 · H2O + 4NO2 + H2O
С разбавленной образует нитрат олова ( II ) :
3Sn + 8HNO3 → 3Sn( NO3 )2 + 2NO + 4H2O
С кислородом олово образует оксид олова ( II ) SnO и оксид олова ( IV ) SnO2 .
Sn + O2 → SnO
Оксид олова также можно в результате слабого нагрева гидроксида олова ( II )
t
Sn( OH )2 → SnO + H2O
При хранении на воздухе оксид олова ( II ) медленно окисляется до оксида ( IV )
2SnO + O2 → 2SnO2
Оксиды олова ( II ) отвечает гидроксид олова ( II ) Sn( OH ), обладая амфотерными свойствами , например :
SnCI2 + 2NaOH = Sn( OH )2 + 2NaCl
Гидроксид олова ( II ) растворяется в кислотах и щелочах . Уравнение реакции в ионном виде :
Sn( OH )2 + 2H⁺ = Sn²⁺ + 2H2O
Sn( OH )2 + 2OH⁻ = SnO²⁻2 + 2H2O
Соли , имеющие в своём составе ион SnO²⁻2 , называются станнитами . Например , Na2SnO2 -станнит натрия .
Оксид олова ( IV ) имеет свойства кислотного ангидрида . Ему отвечают оловянные кислоты и их соли станнаты : H2SnO3 ( оловянная кислота или метаоловянная кислота ) , Na2SnO3 — ( станнат натрия )
Лит.: Мурач Н. Н. . Металлургия олова. М., Селиванов И. М., Баймаков А. Ю. Полупромышленное производство олова высокой чистоты.
Вы читаете, статья на тему олово
Использование
В качестве основной характеристики, позволяющей применять олово, выделяют его высокую коррозионную устойчивость. Данный металл, а также его сплавы являются одними из самых устойчивых соединений по отношению к агрессивным химическим веществам. Больше половины всего олова, производимого в мире, применяется для изготовления белой жести. Данную технологию, связанную с нанесением на сталь тонкого слоя олова, стали применять для защиты от химической коррозии консервных банок.
Способность олова к раскатыванию используется для производства из него тонкостенных труб. Из-за неустойчивости данного металла к низким значениям температур его бытовое использование достаточно ограничено.
У сплавов олова значение теплопроводности существенно ниже, чем у стали, поэтому их можно применять для производства умывальников и ванн, а также для изготовления различной сантехнической фурнитуры.
Олово подходит для производства незначительных декоративных и бытовых предметов, изготовления посуды, создания оригинальных ювелирных украшений. Этот неяркий и ковкий металл при объединении с медью давно стал одним из самых излюбленных материалов скульпторов. Бронза объединяет в себе высокую прочность, стойкость к химической и естественной коррозии. Этот сплав востребован в качестве декоративного и строительного материала.
Олово является тонально-резонансным металлом. Например, при его соединении со свинцом получают сплав, применяемый для изготовления современных музыкальных инструментов. С древних времен известны бронзовые колокола. Для создания органных труб применяют сплав олова со свинцом.

Физические и химические свойства Править
Из-за сильного различия структур двух модификаций олова разнятся и их электрофизические свойства. Так, β-Sn — металл, а α-Sn относится к числу полупроводников. Ниже 3,72 К α-Sn переходит в сверхпроводящее состояние. Стандартный электродный потенциал Sn2+/Sn равен −0.136 В, пары Sn4+/Sn2+ 0.151 В.
При комнатной температуре олово, подобно соседу по группе германию, устойчиво к воздействию воздуха или воды. Такая инертность объясняется образованием поверхностной пленки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150°C:
Sn + O2 = SnO2.
Sn + 2Cl2 = SnCl4.
С концентрированной соляной кислотой олово медленно реагирует:
Возможно также образование хлороловянных кислот составов HSnCl3, H2SnCl4 и других, например:
В разбавленной серной кислоте олово не растворяется, а с концентрированной реагирует очень медленно.
При взаимодействии с разбавленной азотной кислотой олово проявляет свойства металла. В результате реакции образуется соль — нитрат олова (II):
SnCl4 + Li[AlH4] = SnH4 + LiCl + AlCl3.
Этот гидрид весьма нестоек и медленно разлагается уже при температуре 0 °C.
Олову отвечают два оксида: SnO2 (образующийся при обезвоживании оловянных кислот) и SnO. Последний можно получить при слабом нагревании гидроксида олова (II) Sn(OH)2 в вакууме:
Sn(OH)2 = SnO + H2O.
2SnO = Sn + SnO2.
При хранении на воздухе SnO постепенно окисляется:
2SnO + O2 = 2SnO2.
При гидролизе растворов солей олова (IV) образуется белый осадок — так называемая α-оловянная кислота:
SnCl4 + 4NH3 + 6H2O = H2[Sn(OH)6] + 4NH4Cl.
H2[Sn(OH)6] = α-SnO2·nH2O↓ + 3H2O.
Свежеполученная α-оловянная кислота растворяется в кислотах и щелочах:
α-SnO2·nH2O + KOH = K2[Sn(OH)6],
α-SnO2·nH2O + HNO3 = Sn(NO3)4 + H2O.
При хранении α-оловянная кислота стареет, теряет воду и переходит в β-оловянную кислоту, которая отличается большей химической инертностью. Данное изменение свойств связывают с уменьшением числа активных HO-Sn группировок при стоянии и замене их на более инертные мостиковые -Sn-O-Sn- связи.
При действии на раствор соли олова (II) растворами сульфидов выпадает осадок сульфида олова (II):
Sn2+ + S2- = SnS↓.
SnS + (NH4)2S2 = SnS2 + (NH4)2S.
Образующийся дисульфид SnS2 растворяется в растворе сульфида аммония (NH4)2S:
SnS2 + (NH4)2S = (NH4)2SnS3.
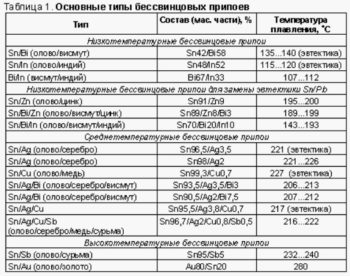
Низкотемпературные припои
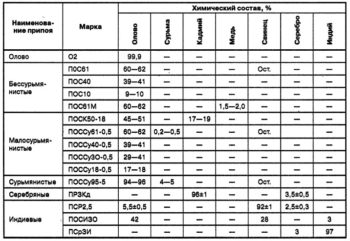
Низкотемпературные сплавы используются для пайки радиодеталей, чувствительных к действию высокой температуры. К ним относятся: припой ПОС 40 и припой ПОС 30. Они широко применяются в промышленности, но их также берут и для частного использования.
ПОС 30 отлично подходит для пайки меди и сплавов не ее основе. Он используется и как присадочный материал и в целях лужения деталей. Особенностью данной марки является отсутствие в ее составе сурьмы.
ПОС 30 позволяет получать надежные герметичные соединения, что обусловило активное применение материала для трубопроводных систем. Кроме того, он характеризуется хорошей проводимостью и низким сопротивлением, что позволяет использовать его с целью получения мелких контактов.
Низкая температура плавления позволяет избежать перегрева радиодеталей при пайке. В то же время, после застывания, он надежно фиксирует части изделия.
С технической точки зрения выполнять пайку данным сплавом достаточно легко. Однако следует иметь в виду, что в случае его использования детали не должны работать при высоких температурах.
Выпускается ПОС 30 в форме проволоки различного диаметра от 0,5 до 8 мм. Толщину выбирают исходя из задач, которые необходимо решить. Чтобы соединить мелкие провода и детали, отлично подойдет наименьший вариант. А вот ремонт корпусов и спайку крупных изделий проще осуществлять 8 мм проволокой.
Припой ПОС 40 имеет близкие технические характеристики к ПОС 30. В состав также не входит сурьма. Он относится к низкотемпературному классу. Плотности отмеченных сплавов и начало температуры плавления также одинаковы.
Отличаются они друг от друга, конечно же, составом. Об этом свидетельствуют цифры в конце их маркировки.
ПОС 40 позволяет получать качественные и надежные соединения. При работе с ним не появляются трещины, а также отсутствуют не пропаянные места и другие дефекты. Незначительное сопротивление и хорошая проводимость позволяют применять ПОС для пайки электроники.
Как уже было отмечено выше, данный припой имеет низкую температуру плавления. Это также накладывает ограничения на использование изделий паяемых с его применением.
Наиболее распространенная форма выпуска сплава – проволока. Ее диаметр варьируется от 0,5 до 7 мм. Однако он существует и в виде прутков, ленты фольги, небольших трубок.
Еще одним низкотемпературным припоем является ПОС 61. Однако у него в составе присутствует сурьма. Сплав отличается достаточно хорошей пластичностью. Наиболее широко используется для пайки полупроводниковой техники. Удельное сопротивление припоя ПОС 61 составляет 0,139 Ом*мм 2 /м.
Выпускается в виде металлических слитков весом около 25 кг, прутков с сечением от 8 до 15 мм, проволоки с диаметром от 0,5 до 6 мм. Существуют также такие форм-факторы, как ленты, аноды и трубки.
Какие бывают припои
Существует большое количество материалов для пайки, основное разделение происходит на мягкие и твердые. Монтаж радиоаппаратуры происходит при помощи легкоплавкого, его температура плавления колеблется от 300 до 450 °C. По прочности мягкие виды припоев не уступают при пайке другим, используются при сборке практически всех электронных изделий.
Некоторые тугоплавкие припои имеют легирующие стали, что по позволяет реализовать некоторые параметры при соединении. Примеси используются для достижения определенных характеристик, антикоррозийных свойств, уровней прочности. Припой для пайки используется в большинстве случаев марки ПОС, что означает оловянно – свинцовые припои. Число указывает на процентное содержание составом олова.

Оловяно-свинцовый припой
Если происходит ситуация, когда припои и флюсы применяемые при пайке неизвестного происхождения, отличить можно по следующим физиологическим свойствам:
- Температура плавления свинцово – оловянных припоев варьируется в пределах от 183 до 265 °C.
- Яркий металлический отблеск выдает высокое содержание олова, предположительно марка ПОС-61 и выше.
- Большое содержание свинца выдается тусклым серым оттенком, матовой поверхностью.
- Большое количество свинца повышает пластичность проволоки, изделие диаметром 6 мм можно легко согнуть руками, а более качественное не гнаться.
Различные виды припоя производятся изготовителями при некоторых факторах. Большинством современных материалов пайки применяется допуск флюса от 1 до 3%, что значительно улучшает условия работы. Нет необходимости подносить жало паяльного инструмента к флюсу каждый раз, если он содержится сердцевиной припоя. Разновидностью свинцово – оловянных изделия является припой марки ПОССу. Обозначение предполагает добавление сурьмы, применяется в различных производствах, подходит к применению с оловянными деталями.

Припой Sn63Pb37
Наиболее распространенным при спайке и лужении медных, бронзовых деталей, через которые проходит течение тока, является припой третник. Температура плавления данной разновидности составляет 190 °C, получается герметичный шов. Зарубежным аналогом считается Sn63Pb37, где соответствующее названию содержание олова к свинцу.
Применение
- В качестве катализатора
В сочетании с оксидами ванадия его используют в качестве катализатора для окисления ароматических соединений в синтезе карбоновых кислот и ангидридов кислот, катализатора реакций замещения и гидролиза.
- В датчиках газообразных горючих газов.
Плёнки из диоксида олова, нанесённые на стекло или керамику применяются в датчиках горючих газов в воздухе — метана, пропана, оксида углерода и других горючих газов. Нагретый до температуры в несколько сотен градусов Цельсия материал в присутствии горючих газов обратимо частично восстанавливается с изменением стехиометрического соотношения в сторону обеднения кислородом, что приводит к снижению электрического сопротивления плёнки. Для применения в датчиках газа изучалось легирование диоксида олова различными соединениями, например, оксидом меди(II).
- В электронной промышленности
Основное применение соединения для создания прозрачных токопроводящих плёнок в различных приборах — жидкокристаллических дисплеях, фотогальванических элементах и в других приборах. Нанесение плёнки вещества производится из газовой фазы разложением летучих соединений олова, для повышения электропроводности соединение обычно легируют сурьмой и соединениями фтора.
Также применяется для создания прозрачных проводящих обогревательных противообледенительных плёнок на стеклянной поверхности окон транспортных средств.
Применяется в материалах контактов электрических коммутационных аппаратов, например, серебряных контактов электромагнитных реле — в материал вводят 2—14 % диоксида олова. Ранее для этой цели использовали весьма токсичный оксид кадмия.
Легирование кобальтом и марганцем дает материал, который можно использовать, например, в высоковольтных варисторах.
Легирование диоксида олова оксидами железа или марганца образует высокотемпературный ферромагнитный материал.
- В стекольной и керамической промышленности в качестве белого пигмента
Диоксид олова плохо растворяется в расплавленной силикатной или боросиликатной стекломассе и имеет высокий показатель преломления относительно силикатного связующего, поэтому его микрочастицы в составе стёкол рассеивают свет, придавая стеклянной массе молочно-белый цвет и используется в производстве матовых стёкол, глазурованной керамической настенной плитке, сантехнических фаянсовых изделиях и др.
Изменяя состав стекломассы и технологию её приготовления можно изменять степень матовости продукта, так как растворимость диоксида олова увеличивается при повышении температуры обжига и увеличении концентрации в стекломассе оксидов щелочных металлов (Na2O,K2O{\displaystyle {\ce {Na2O, K2O}}}) и оксида бора B2O3{\displaystyle {\ce {B2O3}}} и снижается при увеличении содержания оксидов щелочноземельных металлов (CaO,BaO{\displaystyle {\ce {CaO, BaO}}}), оксидов алюминия, цинка и свинца. Чистый диоксид олова придаёт глазури белый цвет, который можно изменить добавлением оксидов других элементов, например, оксид ванадия придаёт глазури жёлтый цвет, хрома — розовый, сурьмы — серовато-синий.
- Покрытия на стекле
Тончайшие плёнки диоксида олова (~0,1 мкм) применяются в качестве адгезионного подслоя для нанесения на поверхность стеклянной посуды (в основном на бутылках, банках, сортовой посуде) полимерного покрытия, например, полиэтиленового. Нанесение таких тонких плёнок производится разложением на поверхности горячего стеклянного изделия летучих соединений олова, например, тетрахлорида олова или оловоорганических соединений, например, трихлорида бутилолова.
- В качестве абразивного материала
Микрокристаллы соединения имеют высокую твёрдость и применяется в составе полировальных паст и суспензий для полировки изделий их металлов, стекла, керамики, природных камней.









