Температура плавления металлов и сплавов с таблицей
Содержание:
- Физика8 класс
- § 13. Плавление и отвердевание кристаллических тел
- Осаждение веществ реагентами
- Примечания
- «Плавление и кристаллизация. Удельная теплота плавления»
- Предсказание температуры плавления (критерий Линдемана)
- ПРИМЕРЫ ЗАДАНИЙ
- Примечания
- Изотермический способ и высаливание
- Публикации по теме кристаллизации
- Примечания
- Практический пример: значение скорости охлаждения для кристаллизации
- Примеры
- Кинетическая и потенциальная энергия
- Плавление льда
- Предсказание температуры плавления (критерий Линдемана)
- Металлы
- Подробное объяснение почему при плавлении температура не меняется
Физика8 класс
§ 13. Плавление и отвердевание кристаллических тел
Передавая телу энергию, можно перевести его из твёрдого состояния в жидкое (например, расплавить лёд), а из жидкого — в газообразное (превратить воду в пар).
Если газ отдаёт энергию, то может превратиться в жидкость, а жидкость, отдавая энергию, может превратиться в твёрдое тело.
Переход вещества из твёрдого состояния в жидкое называют плавлением.
Чтобы расплавить тело, нужно сначала нагреть его до определённой температуры.
Температуру, при которой вещество плавится, называют температурой плавления вещества.
Плавление олова в стальной ложке
Одни кристаллические тела плавятся при низкой температуре, другие — при высокой. Лёд, например, можно расплавить, внеся его в комнату. Кусок олова или свинца — в стальной ложке, нагревая её на спиртовке. Железо плавят в специальных печах, где достигается высокая температура.
Из таблицы 3 видно, в каких широких пределах лежат температуры плавления различных веществ.
Таблица 3.
Температура плавления некоторых веществ (при нормальном атмосферном давлении)

Например, температура плавления металла цезия 29 °С, т. е. его можно расплавить в тёплой воде.
Переход вещества из жидкого состояния в твёрдое называют отвердеванием или кристаллизацией.
Чтобы началась кристаллизация расплавленного тела, оно должно остыть до определённой температуры.
Температура, при которой вещество отвердевает (кристаллизуется), называют температурой отвердевания или кристаллизации.
Опыт показывает, что вещества отвердевают при той же температуре, при которой плавятся. Например, вода кристаллизуется (а лед плавится) при 0 °С, чистое железо плавится и кристаллизуется при температуре 1539°С.
Вопросы
- Какой процесс называют плавлением?
- Какой процесс называют отвердеванием?
- Как называют температуру, при которой вещество плавится и отвердевает?
Упражнение 11
- Будет ли плавиться свинец, если его бросить в расплавленное олово? Ответ обоснуйте.
- Можно ли в алюминиевом сосуде расплавить цинк? Ответ обоснуйте.
- Почему для измерения температуры наружного воздуха в холодных районах применяют термометры со спиртом, а не с ртутью?
Задание
- Какой из металлов, приведённых в таблице 3, самый легкоплавкий; самый тугоплавкий?
- Сравните температуры плавления твёрдой ртути и твёрдого спирта. У какого из этих веществ температура плавления выше?
Осаждение веществ реагентами
Это самый распространенный метод кристаллизации в химии. Он является наиболее быстрым и простым.
Если в процессе образуется продукт реакции, практически не растворяющийся в воде, то он тут же выпадает в осадок из раствора. Что в противном случае? Если продукту реакции свойственна растворимость, то начало кристаллизации приходится на тот момент, когда жидкость достигает необходимого уровня пресыщения. И продолжается процесс до тех пор, пока в нее поступает осадитель (реагент).
Яркий пример – получение карбоната кальция. Он нерастворим. Так что приходится использовать конверсию нитрата кальция в нитрат алюминия. Взглянув на формулу, можно понять, как примерно происходит данный процесс: Са (NO3)2 + (NH4)2CO3 = CaCO3 + 2NH4NO3.
Чтобы получить катализаторы, прибегают к осаждению металлов в виде нерастворимых веществ. К ним относятся оксалаты, гидроксиды, карбонаты и прочие соли. Их осаждают, потому что впоследствии они разлагаются до оксидов.

Примечания
- С. Т. Жуков Химия 8-9 класс, Глава 1. Основные представления и понятия химии
- Разброс экспериментальных данных связан, по видимому, с фазовым переходом графит-карбин и различной скоростью нагрева при измерениях. Климовский И. И., Марковец В. В. Влияние фазового перехода графит-карбин на излучательную способность графитовых образцов при их нагревании до температур 3000 K и более // International Scientific Journal for Alternative Energy and Ecology. — 2007. — № 6 (50). — С. 50-59.
- Андреев В. Д. Избранные проблемы теоретической физики.. — Киев: Аванпост-Прим,. — 2012.
- Мейер К. Физико-химическая кристаллография, М., «Металлография», 1972
- Lindemann F. A. // Phys.Z., 1910, v.11, p.609
- Wood W. W., Jacobson J. D. Preliminary Results from a Recalculation of the Monte Carlo Equation of State of Hard Spheres // J. Chem. Phys.. — 1957. — № 27. — С. 1207. — DOI:10.1063/1.1743956.
- Alder B. J., Wainwright T. E. Phase Transition in Elastic Disks // Phys. Rev.. — 1962. — № 127. — С. 359. — DOI:10.1103/PhysRev.127.359.
- Hoover W. G., Gray S. G., Johnson K. W. Thermodynamic Properties of the Fluid and Solid Phases for Inverse Power Potentials // J. Chem. Phys.. — 1971. — № 55. — С. 1128. — DOI:10.1063/1.1676196.
- Пайнс Д. Элементарные возбуждения в твёрдых телах. М., Мир, 1965.
- Андреев В. Д. Крэш (crash)-конформационная кинематика ковалентной решетки алмаза при плавлении. // Журнал структурной химии. — 2001. — № 3. — С. 486-495.
- Андреев В. Д. «Фактор плавления» при межатомных взаимодействиях в алмазной решетке. // Химическая физика. — 2002. — № 8,т.21. — С. 35-40.
«Плавление и кристаллизация. Удельная теплота плавления»
Плавление
Плавление — это процесс превращения вещества из твёрдого состояния в жидкое.
Наблюдения показывают, что если измельчённый лёд, имеющий, например, температуру –10 °С, оставить в тёплой комнате, то его температура будет повышаться. При 0 °С лёд начнет таять, а температура при этом не будет изменяться до тех пор, пока весь лёд не превратится в жидкость. После этого температура образовавшейся изо льда воды будет повышаться.
Это означает, что кристаллические тела, к которым относится и лед, плавятся при определённой температуре, которую называют температурой плавления
Важно, что во время процесса плавления температура кристаллического вещества и образовавшейся в процессе его плавления жидкости остаётся неизменной
В описанном выше опыте лёд получал некоторое количество теплоты, его внутренняя энергия увеличивалась за счёт увеличения средней кинетической энергии движения молекул. Затем лёд плавился, его температура при этом не менялась, хотя лёд получал некоторое количество теплоты. Следовательно, его внутренняя энергия увеличивалась, но не за счёт кинетической, а за счёт потенциальной энергии взаимодействия молекул. Получаемая извне энергия расходуется на разрушение кристаллической решетки. Подобным образом происходит плавление любого кристаллического тела.
Аморфные тела не имеют определённой температуры плавления. При повышении температуры они постепенно размягчаются, пока не превратятся в жидкость.
Кристаллизация
Кристаллизация — это процесс перехода вещества из жидкого состояния в твёрдое состояние. Охлаждаясь, жидкость будет отдавать некоторое количество теплоты окружающему воздуху. При этом будет уменьшаться её внутренняя энергия за счёт уменьшения средней кинетической энергии его молекул. При определённой температуре начнётся процесс кристаллизации, во время этого процесса температура вещества не будет изменяться, пока всё вещество не перейдет в твёрдое состояние. Этот переход сопровождается выделением определённого количества теплоты и соответственно уменьшением внутренней энергии вещества за счёт уменьшения потенциальной энергии взаимодействия его молекул.
Таким образом, переход вещества из жидкого состояния в твёрдое состояние происходит при определённой температуре, называемой температурой кристаллизации. Эта температура остаётся неизменной в течение всего процесса плавления. Она равна температуре плавления этого вещества.

На рисунке приведён график зависимости температуры твёрдого кристаллического вещества от времени в процессе его нагревания от комнатной температуры до температуры плавления, плавления, нагревания вещества в жидком состоянии, охлаждения жидкого вещества, кристаллизации и последующего охлаждения вещества в твёрдом состоянии.
Удельная теплота плавления
Различные кристаллические вещества имеют разное строение. Соответственно, для того, чтобы разрушить кристаллическую решётку твёрдого тела при температуре его плавления, необходимо ему сообщить разное количество теплоты.
Удельная теплота плавления — это количество теплоты, которое необходимо сообщить 1 кг кристаллического вещества, чтобы превратить его в жидкость при температуре плавления. Опыт показывает, что удельная теплота плавления равна удельной теплоте кристаллизации.
Удельная теплота плавления обозначается буквой λ. Единица удельной теплоты плавления — = 1 Дж/кг.
Значения удельной теплоты плавления кристаллических веществ приведены в таблице. Удельная теплота плавления алюминия 3,9*105 Дж/кг. Это означает, что для плавления 1 кг алюминия при температуре плавления необходимо затратить количество теплоты 3,9*105 Дж. Этому же значению равно увеличение внутренней энергии 1 кг алюминия.
Чтобы вычислить количество теплоты Q, необходимое для плавления вещества массой m, взятого при температуре плавления, следует удельную теплоту плавления λ умножить на массу вещества: Q = λm.
Эта же формула используется при вычислении количества теплоты, выделяющегося при кристаллизации жидкости.

Конспект урока «Плавление и кристаллизация. Удельная теплота плавления».
Следующая тема: «Тепловые машины. ДВС. Удельная теплота сгорания топлива».
Предсказание температуры плавления (критерий Линдемана)
Попытка предсказать точку плавления кристаллических материалов была предпринята в 1910 году Фредериком Линдеманом (англ.). Идея заключалась в наблюдении того, что средняя амплитуда тепловых колебаний увеличивается с увеличением температуры. Плавление начинается тогда, когда амплитуда колебаний становится достаточно большой для того, чтобы соседние атомы начали частично занимать одно и то же пространство.
Критерий Линдемана утверждает, что плавление ожидается, когда среднеквадратическое значение амплитуды колебаний превышает пороговую величину.
Температура плавления кристаллов достаточно хорошо описывается формулой Линдемана:
- Tλ=xm29ℏ2MkBθrs2{\displaystyle T_{\lambda }={\frac {x_{m}^{2}}{9\hbar ^{2}}}Mk_{B}\theta r_{s}^{2}}
где rs{\displaystyle r_{s}} — средний радиус элементарной ячейки, θ{\displaystyle \theta } — температура Дебая, а параметр xm{\displaystyle x_{m}} для большинства материалов меняется в интервале 0,15-0,3.
Температура плавления — Расчет
Формула Линдемана выполняла функцию теоретического обоснования плавления в течение почти ста лет, но развития не имела из-за низкой точности.
ПРИМЕРЫ ЗАДАНИЙ
Часть 1
1. В процессе плавления кристаллическое твёрдое тело становится жидкостью. При этом
1) уменьшается внутренняя энергия тела 2) увеличивается средняя кинетическая энергия молекул 3) увеличивается внутренняя энергия тела 4) уменьшается средняя кинетическая энергия молекул
2. В одном сосуде находится лёд при температуре 0 °С, в другом — такая же масса воды при температуре 0 °С. Внутренняя энергия льда
1) равна внутренней энергии воды 2) больше внутренней энергии воды 3) меньше внутренней энергии воды 4) равна нулю
3. На рисунке представлен график зависимости температуры от времени для процесса нагревания льда. Процессу плавления льда соответствует участок графика
1) AB 2) BC 3) CD 4) DE
4. На рисунке приведён график зависимости температуры некоторого вещества от времени. Первоначально вещество находилось в жидком состоянии. Какая точка графика соответствует началу процесса отвердевания вещества?
1) А 2) Б 3) В 4) Г
5. На рисунке приведён график зависимости температуры некоторого вещества от времени. Первоначально вещество находилось в жидком состоянии. Какая точка графика соответствует окончанию процесса отвердевания вещества?
1) А 2) Б 3) В 4) Г
6. На рисунке изображён график зависимости температуры тела от времени. Первоначально тело находилось в жидком состоянии. Какой процесс характеризует отрезок БВ?
1) нагревание 2) охлаждение 3) плавление 4) кристаллизацию
7. На рисунке представлен график зависимости температуры \( t \) от времени \( \tau \) при непрерывном нагревании и последующем непрерывном охлаждении вещества, первоначально находящегося в твёрдом состоянии. В каком состоянии находится вещество в точке Е?
1) только в жидком 2) только в твёрдом 3) только в газообразном 4) часть — в жидком, часть — в твёрдом
8. Удельную теплоту плавления можно рассчитать по формуле
1) \( \frac{Q}{m(t_2-t_1)} \) 2) \( \frac{Q}{m} \) 3) \( \frac{Q}{(t_2-t_1)} \) 4) \( \lambda m \)
9. Чему равно количество теплоты, которое необходимо затратить на полное превращение 2 кг свинца в жидкое состояние, если его начальная температура 27 °С?
1) 50 кДж 2) 78 кДж 3) 128 кДж 4) 15000 кДж
10. Какое количество теплоты выделяется при превращении 500 г воды, взятой при 0 °С, в лёд при температуре -10 °С? Потерями энергии на нагревание окружающего воздуха пренебречь.
1) 10500 Дж 2) 175 500 Дж 3) 165 000 Дж 4) 10500 Дж
11. На рисунке представлен график зависимости температуры некоторого вещества от полученного количества теплоты. Первоначально вещество находилось в твёрдом состоянии.

Используя данные графика, выберите из предложенного перечня два верных утверждения. Укажите их номера.
1) Удельная теплоёмкость вещества в твёрдом состоянии равна удельной теплоёмкости вещества в жидком состоянии. 2) Температура кипения вещества равна tx. 3) В точке В вещество находится в твёрдом состоянии. 4) В процессе перехода из состояния Б в состояние В внутренняя энергия вещества увеличивается. 5) Участок графика ГД соответствует процессу плавления вещества.
12. На рисунке представлены графики зависимости температуры от полученного количества теплоты для двух веществ одинаковой массы. Первоначально каждое из веществ находилось в твёрдом состоянии.

Используя данные графиков, выберите из предложенного перечня два верных утверждения. Укажите их номера.
1) Удельная теплоёмкость первого вещества в твёрдом состоянии меньше удельной теплоёмкости второго вещества в твёрдом состоянии. 2) В процессе плавления первого вещества было израсходовано большее количество теплоты, чем в процессе плавления второго вещества. 3) Представленные графики не позволяют сравнить температуры кипения двух веществ. 4) Температура плавления второго вещества выше. 5) Удельная теплота плавления у второго вещества больше.
Часть 2
13. Зависимость температуры 1 л воды от времени при непрерывном охлаждении представлена на графике. Какое количество теплоты выделилось при кристаллизации воды и охлаждении льда?

Примечания
- Разброс экспериментальных данных связан, по видимому, с фазовым переходом графит-карбин и различной скоростью нагрева при измерениях.
- Мейер К. Физико-химическая кристаллография, М., «Металлография», 1972
- Lindemann F. A. // Phys.Z., 1910, v.11, p.609
- Пайнс Д. Элементарные возбуждения в твёрдых телах. М., Мир, 1965.
- Андреев В. Д. Крэш (crash)-конформационная кинематика ковалентной решетки алмаза при плавлении. // Журнал структурной химии. — 2001. — № 3. — С. 486-495.
- Андреев В. Д. «Фактор плавления» при межатомных взаимодействиях в алмазной решетке. // Химическая физика. — 2002. — № 8,т.21. — С. 35-40.
Изотермический способ и высаливание
Об этом тоже следует рассказать. Изотермический процесс кристаллизации характеризуется испарением воды из растворов при постоянной, не меняющейся температуре. Этот метод применим для веществ с содержанием солей, растворимость которых практически не зависит от нагревания.
Испарения удается добиться за счет доведения жидкости до интенсивного кипения и поддержания ее в таком состоянии. Это «традиционный» метод. Еще может использоваться медленное поверхностное испарение.
В некоторых случаях в жидкости вводят вещества, которые понижают их способность к растворению. Это называется высаливанием. Такими «помощниками» являются вещества, в которых содержится одинаковый с данной солью ион. Яркий пример: процесс кристаллизации хлорида натрия из раствора с высокой концентрацией, в который добавляют хлорид магния.
Следует оговориться, что механизм высаливания не всегда одинаков. Если в целях проведения данного процесса смешать два электролита, добавочный из которых будет с одноименным ионом, то в итоге получится добиться такой концентрации, что произведение растворимости вещества станет значительно выше. Что это значит? Говоря простыми словами – появится избыток вещества, и он выделится в твердую фазу.
Бывает и по-другому. Чтобы добиться высаливания, приходится и вовсе менять структуру раствора – способствовать образованию гидратных оболочек вокруг частиц вещества, которое необходимо кристаллизовать. Как это достигается? Посредством разрушения оболочек у уже растворенного вещества.
Важно усвоить: соли, которые образуют кристаллогидраты, высаливаются интенсивнее, чем те, которые образуются в безводной форме. Но некоторые «добавки» лишь усиливают растворимость
Это приводит к всаливанию.
Публикации по теме кристаллизации
Ознакомьтесь с подборкой статей по теме кристаллизации:
Классическая работа по нуклеации кристаллов из растворовJaroslav Nývlt, Kinetics of nucleation in solutions, Journal of Crystal Growth, Volumes 3–4, 1968.
Исследование механизмов выращивания кристаллов из раствораCrystal Growth Kinetics, Material Science and Engineering, Volume 65, Issue 1, July 1984.
Описание причин, по которым в системах «растворенное вещество — растворитель» вместо кристаллизации происходит образование новой жидкой фазыKiesow et al., Experimental investigation of oiling out during crystallization process, Journal of Crystal Growth, Volume 310, Issue 18, 2008.
Подробное исследование причин агломерации кристаллов в процессе кристаллизацииBrunsteiner et al., Toward a Molecular Understanding of Crystal Agglomeration, Crystal Growth & Design, 2005, 5 (1), pp 3–16.
Исследование механизмов распада агломератов в процессе кристаллизацииFasoli & Conti, Crystal breakage in a mixed suspension crystallizer, Volume 8, Issue 8, 1973, Pages 931–946.
Обзор алгоритмов разработки эффективных процессов кристаллизации в высокотехнологичных сегментах химической промышленностиPaul et al., Organic Crystallization Processes, Powder Technology, Volume 150, Issue 2, 2005.
Примечания
- Дрица М. Е., Будберг П. Б., Бурханов Г. С., Дриц А. М., Пановко В. М. Свойства элементов. — Металлургия, 1985. — С. 672.
- ↑ , p. 4.122.
- Температура плавления очищенной воды была измерена как 0,002519 ± 0,000002 °C, см.
- Agte, C.; Alterthum, H. Researches on Systems with Carbides at High Melting Point and Contributions to the Problem of Carbon Fusion (англ.) // Z. Tech. Phys. : journal. — 1930. — Vol. 11. — P. 182—191.
- Lindemann FA (англ.)русск.. The calculation of molecular vibration frequencies (нем.) // Phys. Z. : magazin. — 1910. — Bd. 11. — S. 609—612.
- Жирифалько Л. Статистическая физика твердого тела. — М.: Мир, 1975. — С. 15.
- Гаврилин И. В. 3.7. Расчёт температуры плавления металлов // Плавление и кристаллизация металлов и сплавов. — Владимир: Изд. ВлГУ, 2000. — С. 72. — 200 экз. — ISBN 5-89368-175-4.
Практический пример: значение скорости охлаждения для кристаллизации
В этом примере скорость охлаждения в конце процесса вызвала вторичное образование зародышей (зафиксировано зондом ParticleTrack с технологией FBRM), в результате чего образовалось множество мелких частиц. Это было обнаружено в режиме реального времени с помощью видеомикроскопа ParticleView с технологией PVM.
Увеличение скорости охлаждения раствора ведет к более быстрому пересыщению, в результате скорость образования зародышей кристаллов будет выше скорости их роста
Следовательно, чтобы получить нужное распределение кристаллов по размеру, чрезвычайно важно контролировать скорость охлаждения
Дисперсность кристаллов льда, например, влияет на вкус и консистенцию мороженого: так, кристаллы размером менее 50 мкм предпочтительнее кристаллов, которые больше 100 мкм. Она влияет и на технологические свойства распыляемых агрохимикатов: их частицы должны быть малы настолько, чтобы не засорять сопла при распылении, но при этом достаточно большими, чтобы их не уносило на соседние поля.
Примеры
Кристаллизация – это в химии очень тщательно изучаемый процесс, который особенно интересен на практике.
В качестве примера можно рассмотреть процесс образования сахара. Суть процесса заключается в выделении сахарозы, содержащейся в сиропе. Последний, в свою очередь, содержит также другие вещества, которые не были удалены в процессе очистки сока, и вновь образовались по ходу сгущения.
Когда поднимается температура, кристаллизация начинается, и в ее процессе образуется межкристальный раствор, который называется утфель. Все лишние вещества будут скапливаться в нем. На самом деле, они серьезно затрудняют весь процесс, поскольку наличие различного рода примесей увеличивает вязкость раствора.
Еще один яркий пример кристаллизации в химии связан с образованием соли. Для того чтобы его увидеть воочию, даже не нужно проводить экспериментов – данный процесс существует в природе. В холодное время года прибой выбрасывает на берег тонны соли. Она не пропадает. Ее сгребают в огромные кучи, а потом, когда наступает жара и сухость, из нее испаряется кристаллизационная вода. Остается лишь мелкий порошок – соль, потребляемая промышленностью.
Пример с солью – самый простой. Даже в некоторых школах детям дают на дом задание в рамках урока химии: растворить в совсем небольшом количестве воды 1-2 ложки соли и оставить емкость где-нибудь. Для более интенсивной кристаллизации температуру можно увеличить – пододвинуть раствор к батарее, например. Через пару дней вода испарится. А вот солевые кристаллы останутся.
Кинетическая и потенциальная энергия
Чтобы понять, что такое плавление в физике, необходимо ясно представлять соотношение кинетической и потенциальной энергии в твердых и жидких телах.
Потенциальная энергия характеризует работу, которую нужно затратить, чтобы распылить данное тело в пространстве на составляющие его частицы. Для описания этой величины вводят понятие энергии связи, которая обозначает работу, необходимую для того, чтобы оторвать от тела один атом или молекулу и удалить его/ее на бесконечность. Например, типичные значения энергии связи для твердых тел составляют несколько электрон-вольт, эти же значения для жидкостей на порядок меньше.
Кинетическая энергия характеризует интенсивность движения атомов и молекул. В случае конденсированных сред эта энергия прямо пропорционально зависит от температуры.
В твердых телах кинетическая энергия при комнатных температурах составляет несколько сотых электрон-вольт, то есть она в 100 раз меньше потенциальной. Атомы и молекулы в твердых телах находятся как бы в потенциальной яме и колеблются около устойчивых определенных положений. Выбраться они могут из этих положений, если флуктуации кинетической энергии окажутся значительными, или если сама потенциальная яма невелика, например, когда поблизости имеется какой-либо дефект.
Кинетическая энергия атомов и молекул в жидкости приблизительно равна их потенциальной энергии, то есть составляет несколько десятых электрон-вольт при комнатной температуре. Это означает, что каждая частица, составляющая жидкость, постоянно перепрыгивает из одного места в другое. Хорошим доказательством этого факта является Броуновское движение.
Плавление льда
Опыты, как тающий лед превращается в воду, делали все:
кубики в бокале уменьшаются в размере, делая жидкость прохладнее.
Морфологическое превращение льда неизменно сопровождается поглощением тепла.
Формула воды H2O при этом остается неизменной. Что же тогда
меняется? Движение молекул. Они начинают хаотично перемещаться. Таяние льда –
процесс, при котором упорядоченная структура разрушается, кристаллы
трансформируются сначала в кашицу, затем – в жидкое состояние. Такое изменение
требует энергии, она передается из внешней среды молекулам. Изменяется их
внутренняя энергия, она не дает им устоять в углах кристаллической решетки.
Давайте разбираться с температурой. Повышается ли она во время таяния? Лед до
полного превращения в воду своей температуры не изменяет. Это легко проверить с
помощью градусника. При температуре ноль градусов лед становится водой, это
температура плавления. Разрабатывая температурную шкалу, за ноль приняли температуру
трансформации льда и кристаллизации Н2О, как самого встречающегося
вещества в окружающей среде.
Параметр, при котором текучее вещество трансформируется в
твердое состояние, называется температурой кристаллизации. Она совпадает с
параметром, когда лед становится водой, это температура плавления. Для Н2О
она равна нулю. Казалось бы, возникает парадокс: внутренняя энергия молекул под
воздействием внешнего тепла возрастает, а температура в процессе изменения
агрегатного состояния неизменна. Но не будем забывать, что кристаллическая
решетка разрушается, связи между молекулами рвутся, изменяется полярная
ориентация атомов. Кислород смещается к одному полюсу, водород – к другому. Благодаря
этому физико-химическому свойству, вода приобретает текучесть, становится
вязкой.
Предсказание температуры плавления (критерий Линдемана)
Попытка предсказать точку плавления кристаллических материалов была предпринята в 1910 году Фредериком Линдеманом (англ.). Идея заключалась в наблюдении того, что средняя амплитуда тепловых колебаний увеличивается с увеличением температуры. Плавление начинается тогда, когда амплитуда колебаний становится достаточно большой для того, чтобы соседние атомы начали частично занимать одно и то же пространство.
Критерий Линдемана утверждает, что плавление ожидается, когда среднеквадратическое значение амплитуды колебаний превышает пороговую величину.
Температура плавления кристаллов достаточно хорошо описывается формулой Линдемана:
- Tλ=xm29ℏ2MkBθrs2{\displaystyle T_{\lambda }={\frac {x_{m}^{2}}{9\hbar ^{2}}}Mk_{B}\theta r_{s}^{2}}
где rs{\displaystyle r_{s}} — средний радиус элементарной ячейки, θ{\displaystyle \theta } — температура Дебая, а параметр xm{\displaystyle x_{m}} для большинства материалов меняется в интервале 0,15-0,3.
Температура плавления – Расчет
Формула Линдемана выполняла функцию теоретического обоснования плавления в течение почти ста лет, но развития не имела из-за низкой точности.
В 1999г. И.В. Гаврилиным было получено новое выражение для расчёта температуры плавления:
Тпл = DHпл / 1,5 N k, (1)
где Тпл – температура плавления; DHпл – скрытая теплота плавления; N – скрытая теплота плавления; k – константа Больцмана.
Впервые получено исключительно компактное выражение (1) для расчёта температуры плавления металлов, связывающее эту температуру с известными физическими константами: скрытой теплотой плавления, числом Авогадро и константой Больцмана.
Точность расчетов по (1) можно оценить по данным таблицы.
Таблица.
Температура плавления некоторых металлов. Расчет по (1)
| Me | Al | V | Mn | Fe | Ni | Cu | Zn | Sn | Mo |
|---|---|---|---|---|---|---|---|---|---|
| DHпл
ккал моль-1 |
2,5 | 5,51 | 3,5 | 4,4 | 4,18 | 3,12 | 1,7 | 1,7 | 8,7 |
| Тпл, К
по (1) |
876 | 1857 | 1179 | 1428 | 1406 | 1051 | 583 | 529 | 2945 |
| Тпл, К
Эксп. |
933 | 2190 | 1517 | 1811 | 1728 | 1357 | 692 | 505 | 2890 |
По этим данным, точность расчетов Тпл меняется от 2 до 30%, что в расчетах такого рода вполне приемлемо.
Формула (1) выведена как одно из следствий новой теории плавления и кристаллизации, опубликованной в 2000г..
— Гаврилин И.В. Плавление и кристаллизация металлов и сплавов. Изд. ВлГУ. Владимир. 2000. 256 с.
Металлы
Они тоже кристаллизуются. Более того, все твердые металлы, которые мы видим и можем потрогать, являются результатом данного процесса. Превращения, происходящие параллельно, имеют огромное значение, поскольку они в значительной степени определяют свойства металлов.
Кристаллизация, как процесс, весьма интересна в данном случае. Пока вещество находится в жидком состоянии – атомы в нем непрерывно движутся. Естественно, все это время поддерживается соответствующая высокая температура. По мере ее понижения атомы сближаются, вследствие чего происходит их группирование в кристаллы. Так образуются «центры». То есть, первичные группы кристаллов. К ним, по мере замедления движения остальных атомов, присоединяются уже вторичные.
Поначалу кристаллы нарастают беспрепятственно. А те, которые уже образовались, не теряют правильности строения. Но потом кристаллы сталкиваются при дальнейшем движении. Вследствие их контакта форма портится. Однако внутри каждого кристалла строение по-прежнему остается правильным. Эти группы, кстати, именуются зернами. И образуются они не всегда. Все зависит от условий кристаллизации, при какой температуре она происходила (стабильной или нет), а также от природы самого металла.

Подробное объяснение почему при плавлении температура не меняется
Представьте, что вы спокойно пьёте лимонад (который имеет примерно ту же теплоёмкость, что и обычная вода). В этом лимонаде плавают кусочки льда. Температура этой наполовину лимонадной, наполовину ледяной смеси находится вблизи нуля градусов по Цельсию. Пока вы держите в ладонях стакан и наблюдаете за происходящим в нём процессом, лёд начинает таять, однако содержимое ёмкости не нагревается, пока весь лёд в ней не растает.
Вопрос. Почему при плавлении температура не меняется? Тепловая энергия, поступающая из окружающей среды, плавит лёд, не нагревая смесь в целом. Делает ли это уравнение для расчёта количества теплоты (, где — количество теплоты, — масса образца, — изменение температуры) бесполезным? Вовсе нет – это лишь означает, что оно неприменимо к фазовому переходу.
Можно построить график зависимости температуры вещества от количества переданной теплоты . К примеру, на Рис. 1 представлен график фазовых переходов льда, взятого из морозильной камеры. Участок соответствует нагреванию льда, участок — плавлению льда, участок — нагреванию получившейся воды, участок — кипению воды, участок — нагреванию полученного пара.
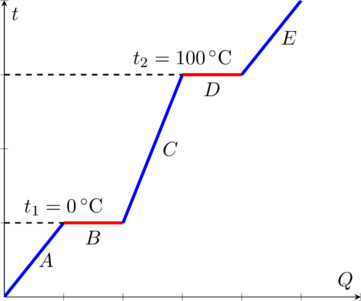
Рис. 1. График фазовых переходов H20.
Как видно, кривая обычно возрастает, то есть увеличение теплоты приводит к возрастанию температуры. Однако кривая идёт горизонтально при фазовых переходах (при температурах и ), поскольку изменение состояния вещества требует энергии. После того, как переход завершается, температура вновь начинает возрастать.
Давайте представим, что вы взяли мешок со льдом и поставил его на кухонную плиту. Перед этим температура льда была ниже температуры замерзания воды, скажем -5 °C. Но на плите она начала изменяться. Пока фазовый переход не происходит, температура льда линейно возрастает при увеличении количества подведенной теплоты , где c = 2100 Дж/(кг⋅°C) — удельная теплоемкость льда.
Когда же лёд достигает температуры в t1 = 0 °C, он становится слишком тёплым, чтобы оставаться в твёрдом состоянии, и начинает плавиться, испытывая фазовый переход (кривая на графике выравнивается). Этот процесс – разрушение кристаллической решётки льда – нуждается в энергии, которая вырабатывается источником тепла. Вот почему при плавлении температура не меняется.
Наблюдая за мешком на плите в течение некоторого времени, вы замечаете, что весь лёд наконец расплавился. Поскольку плита продолжает вырабатывать тепловую энергию, температура воды поднимается. Наконец в ней появляются пузырьки. «Ага, – подумаете вы, – ещё один фазовый переход». Да, это так. Вода становится горячей и при температуре t2 = 100 °C закипает. Мешок при этом начинает раздуваться.
Вы измеряете температуру воды. Удивительно, но пока вода кипит, её температура также не изменяется. И снова, для завершения перехода – из жидкого состояния в газообразное – требуется определённое количество теплоты.
Что же произойдёт дальше, когда мешок расширится до немыслимых размеров? Лучше не проверять, поскольку мешок может взорваться, и вы ошпаритесь горячим паром и кипящей водой.









